今日頭條
PDE3/4抑制劑慢阻肺Ⅲ期臨床成功。Verona Pharma公司吸入用磷酸二酯酶3/4(PDE3/4)抑制劑ensifentrine(RPL554)用于慢性阻塞性肺病維持治療的Ⅲ期臨床(ENHANCE-1)達(dá)到主要和關(guān)鍵次要終點。ensifentrine治療組12周后患者的平均1秒內(nèi)用力呼氣量曲線下面積較基線顯著改善,經(jīng)安慰劑校正后,ensifentrine組數(shù)值達(dá)到87毫升(p<0.0001),將疾病惡化率降低36%(p=0.0505),并降低38%(p=0.0378)的中重度惡化風(fēng)險。預(yù)計明年上半年遞交新藥申請。
國內(nèi)藥訊
1.基石PD-L1單抗在英國報產(chǎn)。基石藥業(yè)PD-L1單抗舒格利單抗的上市許可申請(MAA)獲英國藥監(jiān)部門(MHRA)受理,聯(lián)合化療一線治療轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)。在Ⅲ期GEMSTONE-302研究中,舒格利單抗聯(lián)合化療顯著改善患者的無進(jìn)展生存期和總生存期,研究數(shù)據(jù)已發(fā)表在《柳葉刀·腫瘤學(xué)》上。基石已獨家授權(quán)EQRx公司在大中華區(qū)以外開發(fā)和商業(yè)化舒格利單抗;這也是舒格利單抗的首個海外上市申請。
2.武田口服抗CMV新藥在華報產(chǎn)。武田開發(fā)的pUL97抑制劑馬立巴韋片(Livtencity)的上市申請獲CDE受理,適應(yīng)癥為接受造血干細(xì)胞移植(HSCT)或?qū)嶓w器官移植(SOT)后成人患者的難治性巨細(xì)胞病毒(CMV)感染。Livtencity通過抑制CMV病毒的pUL97蛋白激酶,阻斷病毒的復(fù)制。livtencity已獲得FDA批準(zhǔn)上市,是首個且唯一一款針對這類患者的口服療法。
3.康樂衛(wèi)士九價HPV疫苗啟動Ⅲ期臨床。康樂衛(wèi)士重組九價人乳頭瘤病毒(HPV)疫苗男性適應(yīng)癥Ⅲ期臨床首例受試者入組。該項研究擬召募9000名18~45歲的男性受試者,評估該疫苗對于由HPV 6/11/16/18/31/33/45/52/58型引起的持續(xù)性感染及感染所致的男性生殖器疣、肛門上皮內(nèi)瘤變(AIN)、肛門癌、陰莖/會陰/肛周上皮內(nèi)瘤變(PIN)和陰莖/會陰/肛周癌的預(yù)防效果。目前中國上市的HPV疫苗尚不能用于男性適齡人群接種。
4.賽諾菲CD38抗體啟動中國Ⅲ期臨床。賽諾菲isatuximab注射液(皮下注射)登記啟動一項Ⅲ期臨床,旨在比較isatuximab皮下給藥與靜脈給藥聯(lián)合泊馬度胺和地塞米松治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤(MM)的療效和安全性。這是國際多中心臨床的中國部分,將由北京大學(xué)人民醫(yī)院主任醫(yī)師路瑾博士擔(dān)任主要研究者。isatuximab是一款CD38單抗,其靜脈給藥劑型已獲FDA批準(zhǔn)上市,商品名為Sarclisa。
5.諾誠健華引進(jìn)CD19單抗獲批II期臨床。諾誠健華宣布從Incyte引進(jìn)的一款CD19單抗tafasitamab (Minjuvi®)在中國獲批開展單臂、開放標(biāo)簽、多隊列II期臨床試驗,評估與BTK抑制劑奧布替尼(宜諾凱®)、來那度胺聯(lián)合治療用于復(fù)發(fā)/難治性非霍奇金淋巴瘤(NHL)患者的有效性和安全性。Tafasitamab聯(lián)合來那度胺治療不適合自體干細(xì)胞移植條件的復(fù)發(fā)/難治彌漫性大B細(xì)胞淋巴瘤 (DLBCL) 成人患者的適應(yīng)癥已獲得FDA和EMA有條件批準(zhǔn)上市。
6.信立泰新冠口服藥報IND。信立泰自主研發(fā)的3CL 蛋白酶(3CLpro)抑制劑SAL0133的臨床試驗申請獲CDE受理,擬用于治療輕型/普通型新冠肺炎。在臨床前研究中,SAL0133在酶水平活性顯示出對3CLpro的強抑制活性,對野生毒株及Alpha(B.1)、Beta、Delta、Omicron(BA.2、BA.5)均有積極的抗病毒活性,對Omicron BA.5株的抗病毒活性EC90值是奈瑪特韋的10倍。預(yù)期不需要聯(lián)合CYP3A4抑制劑利托那韋,有望實現(xiàn)臨床單藥用藥。
7.邁威3款生物類似藥海外授權(quán)。邁威生物宣布與俄羅斯Binnopharm Group就9MW0113(君邁康®,阿達(dá)木單抗注射液)、9MW0321(地舒單抗,預(yù)防腫瘤骨轉(zhuǎn)移)和9MW0311(地舒單抗,治療骨質(zhì)疏松)3款生物類似藥在俄羅斯和歐亞經(jīng)濟聯(lián)盟國家地區(qū)內(nèi)的開發(fā)、生產(chǎn)和銷售達(dá)成戰(zhàn)略合作協(xié)議。君邁康®目前已在國內(nèi)獲批8項適應(yīng)癥,包括類風(fēng)濕關(guān)節(jié)炎、強直性脊柱炎、銀屑病、克羅恩病、葡萄膜炎、多關(guān)節(jié)型幼年特發(fā)性關(guān)節(jié)炎、兒童斑塊狀銀屑病和兒童克羅恩病。
國際藥訊
1.Nectin-4靶向ADC聯(lián)合療法獲優(yōu)先審評。FDA授予安斯泰來與Seagen公司開發(fā)的Nectin-4-ADC藥物Padcev(enfortumab vedotin-ejfv)聯(lián)合PD-1單抗Keytruda一線治療不可切除局部晚期或轉(zhuǎn)移性尿路上皮癌(la/mUC)的補充上市申請(sBLA)優(yōu)先審評資格,PDUFA日期定為2023年4月21日。一項Ib/II期EV-103研究隊列K的結(jié)果顯示,聯(lián)合治療的客觀緩解率達(dá)到64.5%(95%CI:52.7-75.1)。但是緩解持續(xù)時間尚未達(dá)到。此前,這一組合用于上述適應(yīng)癥已獲得FDA突破性療法認(rèn)定。
2.HER2雙抗二線治療膽道癌IIb期臨床積極。Zymeworks公司靶向HER2的雙抗藥物zanidatamab用于二線治療膽道癌的IIb期HERIZON-BTC-01研究結(jié)果積極。獨立中央審查(ICR)評估的客觀緩解率(ORR)達(dá)到41.3%(95% CI:30.4,52.8),DOR為12.9個月(95% CI:5.95, NE)。藥物的安全性與既往研究一致。詳細(xì)數(shù)據(jù)將在醫(yī)學(xué)會議上公布。百濟神州擁有zanidatamab在亞洲(日本除外)、澳大利亞和新西蘭的獨家授權(quán)。
3.創(chuàng)新ASO療法治療DMD早期臨床積極。Wave Life Sciences公司反義寡核苷酸(ASO)療法WVE-N531治療杜氏肌營養(yǎng)不良癥(DMD)的Ⅰb/Ⅱa期概念驗證結(jié)果積極。6周的治療結(jié)果顯示,WVE-N531在肌肉中的平均濃度為42 ug/g(6.1 umol);并導(dǎo)致平均53%的外顯子跳躍(范圍:48%-62%);患兒的抗肌萎縮蛋白的平均產(chǎn)生量為正常值的0.27%,低于檢測下限。試驗中無嚴(yán)重的不良事件,也沒有與寡核苷酸類藥物相關(guān)的安全事件。
4.吉利德收購CAR-T生物技術(shù)公司。吉利德旗下公司Kite與Tmunity Therapeutics簽署收購協(xié)議。通過收購,補充了Kite的細(xì)胞療法研究能力和平臺能力,為其提供了細(xì)胞療法項目,包括一個 "armored" CAR T技術(shù)平臺,該平臺有可能應(yīng)用于各種CAR-T,以增強抗腫瘤活性,以及快速制造工藝。Tmunity的前列腺特異性膜抗原(PSMA)和前列腺干細(xì)胞抗原(PSCA)管線將由Tmunity剝離,不屬于Kite的收購范圍。
5.Carrick和美納里尼達(dá)成臨床合作。Carrick Therapeutics同類首創(chuàng)口服CDK7抑制劑samuraciclib(CT7001)擬與美納里尼口服選擇性雌激素受體降解劑(SERD)elacestrant開展一項Ⅱ期臨床,評估聯(lián)合用藥治療CDK4/6i耐藥HR+、HER2-轉(zhuǎn)移性乳腺癌患者的潛力。這項研究將擴大Carrick正在進(jìn)行的samuraciclib臨床試驗組合,預(yù)計Carrick將于2023年啟動這項臨床研究。此外,Carrick還計劃評估samuraciclib對于前列腺癌、胰腺癌、卵巢癌和結(jié)直腸癌的治療作用。
醫(yī)藥熱點
1.山西高職院校單招千名村醫(yī)。山西省招考中心日前透露,山西將繼續(xù)實施在崗鄉(xiāng)村醫(yī)生高職院校單獨招生,共招收符合報名條件的1000名在崗鄉(xiāng)村醫(yī)生,招生列入2023年高職單招計劃。據(jù)悉,2023年山西省在崗鄉(xiāng)村醫(yī)生高職院校單獨招生工作由山西衛(wèi)生健康職業(yè)學(xué)院、忻州職業(yè)技術(shù)學(xué)院承擔(dān),山西衛(wèi)生健康職業(yè)學(xué)院設(shè)臨床醫(yī)學(xué)、中醫(yī)學(xué)和針灸推拿專業(yè),忻州職業(yè)技術(shù)學(xué)院設(shè)臨床醫(yī)學(xué)、針灸推拿專業(yè)。
2.第九屆樹蘭醫(yī)學(xué)獎揭曉。樹蘭人才基金十周年慶典暨第九屆樹蘭醫(yī)學(xué)獎頒獎典禮在浙江省杭州市舉行。中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)院郎景和、中國科學(xué)院大學(xué)附屬腫瘤醫(yī)院譚蔚泓和廣州中醫(yī)藥大學(xué)第二附屬醫(yī)院劉良榮獲樹蘭醫(yī)學(xué)獎。首都醫(yī)科大學(xué)宣武醫(yī)院郝峻巍、浙江大學(xué)基礎(chǔ)醫(yī)學(xué)院張巖等12位青年醫(yī)學(xué)科學(xué)家摘取樹蘭醫(yī)學(xué)青年獎桂冠。
3.國家新冠病毒基因組數(shù)據(jù)庫建立。近日,中國疾控中心病毒病所制定并發(fā)布《我國人群新冠病毒變異株監(jiān)測工作方案》。《方案》要求,每個省份選擇3個城市,每個城市選擇1個哨點醫(yī)院,每個哨點醫(yī)院每周采集15例門急診病例、10例重癥病例和所有死亡病例的標(biāo)本進(jìn)行基因組測序和分析,在1周內(nèi)把測序數(shù)據(jù)進(jìn)行上傳,建立國家新冠病毒基因組數(shù)據(jù)庫,實時動態(tài)監(jiān)測奧密克戎系列變異株在我國流行的動態(tài)。
評審動態(tài)
1. CDE新藥受理情況(12月21日)
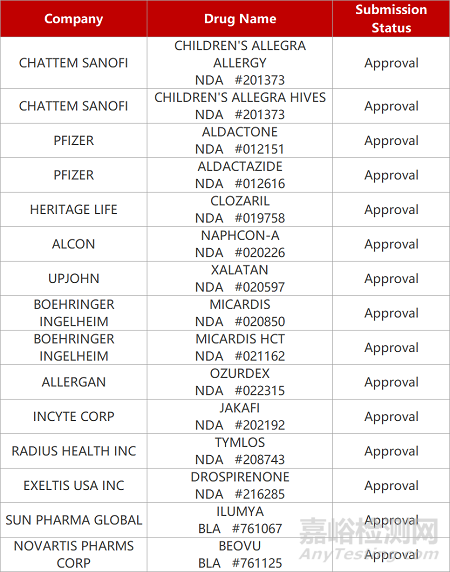
2. FDA新藥獲批情況(北美12月20日)