近期,紐約州立大學石溪分校Donghui Zhu教授課題組在期刊 Bioactive Materials 上發表研究論文。為了提高純鋅的低機械強度和不均勻局部降解行為,考慮其在降解和生物相容性方面的改進潛力,該研究設計并制備的Zn-Fe 合金顯著提高了力學性能并促進了均勻降解,顯示出優異的抗菌性能和體內皮下和股骨組織中的生物相容性。綜上所述,Zn-Fe 合金可能是用于各種心血管、傷口閉合和骨科應用的生物可吸收醫療植入體的理想候選材料。
1、研究內容簡介
可生物降解材料制成的生物可吸收植入體可以臨時支撐受傷的組織,然后在組織恢復過程中慢慢降解,當組織恢復后完全降解無需二次手術。與可降解聚合物相比,可降解的金屬,包括鎂 (Mg)、鐵 (Fe) 和鋅 (Zn),具有更高的機械強度,適用于承重組織應用。鋅具有中等降解速率和顯著的生物學作用,因此被認為是心血管和骨科應用中最有希望的植入體候選材料。盡管如此,純鋅的機械強度仍然低于臨床應用標準。此外,由于純鋅植入體的局部降解行為,它們在降解過程中的機械完整性會進一步降低,從而可能導致植入手術失敗。
為了提高純鋅的低機械強度和不均勻局部降解行為,合金化是解決這些困難的最有效方法之一。在篩選候選合金元素時,考慮其在降解和生物相容性方面的改進潛力,我們提出鐵作為 Zn 的合金元素,并研究了體外和體內這些合金在皮下和股骨組織中的性能。
為了研究 Zn-Fe 合金微觀結構的影響,根據之前對 Zn-Fe 二元體系中的相圖的詳細研究,選擇了 0.4 %和 2.5%(質量百分比)的 Fe 來獲得兩種具有不同百分比金屬間化合物的可降解Zn-Fe合金。眾所周知,塑性變形加工技術可以顯著提高金屬的機械性能,包括機械強度和韌性。因此,在本研究中,我們進一步擠壓 Zn-Fe合金以獲得足夠的機械性能以用于不同需要的醫療應用場景中, 例如心血管、傷口閉合和骨科應用。此外, 實驗探索了大鼠中體內的兩種模型: 皮下植入和股骨植入。這兩個體內植入位置提供了鋅合金植入體在軟組織和硬組織中的綜合評估以應用于不同的生物醫學應用。
圖1. 擠壓態 Zn-Fe 合金的顯微組織和力學行為。(a) 微觀結構(b) XRD 圖譜,η-Zn 和 FeZn13相分別在 Zn-0.4Fe 和 Zn-2.5Fe 合金中占主導地位。(c)力學性能。UTS:極限抗拉強度,YS:屈服強度,ER:斷裂伸長率。兩種合金都顯示出顯著提高的機械強度, 而 Zn-0.4Fe 合金的伸長率(~30%)明顯高于純 Zn(8%)和 Zn-2.5Fe 合金(~10%)。(d)拉伸試驗后的斷裂形貌。
純 Zn 呈現帶解理面的解理斷口形貌,而Zn-0.4Fe合金呈現帶河紋的凹坑斷口形貌。然而,隨著 FeZn13的增加,Zn-2.5Fe合金表現出具有河流紋路的脆性斷裂形貌。
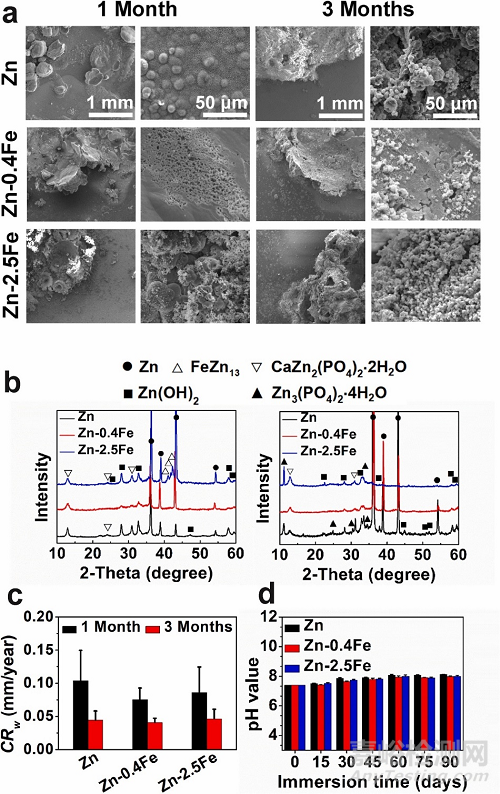
圖2. Zn 和 Zn-Fe 合金在Hanks模擬體液中浸泡1個月和3個月的腐蝕降解行為。(a)表面形貌,(b) XRD 圖譜,(c) 腐蝕速率,(d) pH 值隨浸泡時間的演變。
鋅在長達 1 個月的時間內表現出均勻的降解形貌,但在 3 個月的浸泡過程中轉變為局部降解并出現腐蝕點。少量的鐵添加將降解模式改變為更均勻的降解模式。1個月后其表面出現均勻分布的小凹坑,3個月后在降解表面形成由腐蝕產物組成的薄膜。然而,隨著合金中 Fe 含量的增加,降解模式變為嚴重的局部降解。
圖3.Zn 和 Zn-Fe 合金的細胞相容性和血液相容性。(a) 內皮細胞、(b) 平滑肌細胞和 (c) 血小板的粘附形貌、(d) 內皮細胞和 (e) 平滑肌細胞的細胞活性、(f) 粘附血小板的數量和 (g) 溶血百分比。* p < 0.05,表示與純鋅組相比的差異比較。
與純Zn相比,兩種 Zn-Fe 合金對內皮細胞表現出更高的細胞活性,而Zn-0.4Fe合金對平滑肌細胞的細胞活性降低。所有Zn表面上粘附的血小板數量也相似,在 Zn-2.5Fe 合金上略有增加。兩種合金的溶血率均低于純鋅的溶血率,但均遠低于溶血極限(5%),表明它們具有良好的血液相容性。
圖 4. 純鋅和鋅鐵合金與大腸桿菌和金黃色葡萄球菌一起培養24 小時的抗菌性能。(a) 細菌粘附在樣品表面的 SEM 圖像。(b) 培養基中的抗菌率。
我們之前對純鋅和不銹鋼材料的可比抗菌研究所述,兩種細菌污漬很容易聚集在不銹鋼表面形成厚厚的生物膜。在所有鋅材料的表面上有少量細菌粘附并且沒有生物膜形成。這些材料上甚至有一些破碎的大腸桿菌細胞。所有的Zn材料對金黃色葡萄球菌表現出比大腸桿菌更高的抗菌率。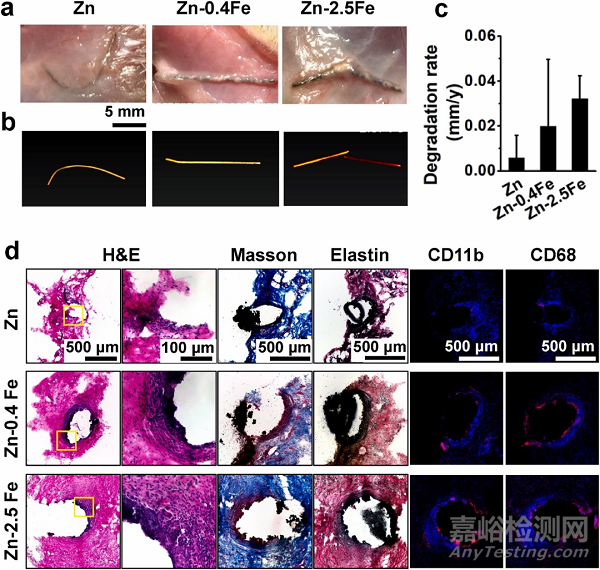
圖 5.(a) 宏觀視圖,(b) 顯微 CT 掃描圖像,和 (c)體內降解速率,以及 (d) 植入大鼠皮下組織3個月后植入體的H&E、Masson、彈性蛋白和免疫熒光染色(CD11b 和 CD68)。
組織學染色顯示所有植入體周圍都有纖維化包裹(圖 5d)。Masson 和 Verhoeff 染色還分別顯示了這些 Zn 植入體的膠原蛋白和彈性蛋白的形成。CD11b 和 CD68 的免疫染色顯示單核細胞/巨噬細胞的聚集。植入3個月后,對純鋅絲植入體幾乎沒有免疫反應。對 Zn-Fe 合金,尤其是 Zn-2.5Fe 合金有更強的免疫反應,這可能與植入體與周圍組織界面處形成的大量降解產物有關。
圖 6. 純 Zn 和 Zn-Fe 合金植入股骨組織 3 個月后的體內降解和骨形成。(a) 顯微 CT 掃描圖像,(b) 降解速率,(c) 橫截面 SEM 圖像和 EDS 元素圖譜,(d) 新骨面積百分比,(e) 骨-植入體接觸比 (BIC),和 (f) 類骨質層厚度。I:植入體,DP:降解產物,OS:類骨質層,NB:新生骨。
EDS圖譜中Ca、P含量較少(圖6c),Masson-Goldner染色呈磚紅色,以及彈性蛋白染色呈淺紅色(圖7),這些都對應類骨質組織,即在成熟骨之前形成的未礦化骨基質。Zn-0.4Fe合金在橫截面上具有松散的降解產物和更深的腐蝕,其顯著更高的骨-植入體接觸比(BIC)表明其更好的骨整合能力。盡管 Zn-2.5Fe 合金也有較厚的降解產物層和類似的類骨質層厚度,但類骨質層確實覆蓋了大部分植入體表面,從而顯著降低了 BIC 值。
圖 7.純 Zn 和 Zn-Fe 合金絲植入大鼠股骨組織 3 個月后Masson-Goldner 和 Elastica van Gieson染色。Masson-Goldner染色中綠色為成骨組織, 類骨質呈磚紅色,而在彈性蛋白Elastica染色中粉紅色為成骨組織, 淺紅色對應類骨質組織。I:植入體,DP:降解產物,OS:類骨質層,NB:新生骨。
與體外細胞相容性相比,體內植入可以直接顯示宿主和組織對鋅材料的反應。所有 Zn 材料周圍都有皮下纖維化包裹組織,但 Zn-Fe 合金最初更強的巨噬細胞活性可能有利于免疫調節和促進愈合過程(圖 5)。與纖維化包裹組織形成類似,類骨質層也出現在股骨植入中。Zn-Fe 合金的降解產物會破壞類骨質組織層的覆蓋,從而與類骨質組織混合(圖 6c)。利用降解產物中高含量的鈣和磷,類骨質組織可以礦化為新形成的骨組織。Zn-0.4Fe 合金的均勻降解行為可能有利于這種生物礦化過程,因此誘導了更高的骨整合。
以上結果表明,Zn-Fe 合金中均勻分布的第二相顯著提高了力學性能并促進了均勻降解,從而增強了它們的生物相容性。均勻分布在 Zn-0.4Fe 合金中的硬而細的 FeZn15相提供了機械強度和延展性的光學組合以及均勻的降解行為。盡管所有 Zn 材料都表現出相似的腐蝕速率、體外細胞粘附、體內纖維化包封和類骨質形成,但 Zn-0.4Fe 合金表現出更好的血液相容性和體內骨整合。此外,這些 Zn-Fe 合金顯示出優異的抗菌性能。綜上所述,Zn-Fe 合金可能是用于各種心血管、傷口閉合和骨科應用的生物可吸收醫療植入體的有希望的候選材料。











