今日頭條
海創URAT1抑制劑報聯合用藥IND����。海創藥業1類化藥HP501緩釋片的臨床試驗申請獲CDE受理,擬聯合黃嘌呤氧化酶(XO)抑制劑用于原發性高尿酸血癥患者的長期治療。HP501是一款高活性、高選擇性URAT1抑制劑�,目前已完成多項單藥治療高尿酸血癥/痛風的Ⅰ/Ⅱ期試驗?,F有的臨床數據顯示�����,HP501在治療高尿酸血癥/痛風方面具有良好的療效及安全性�����。
國內藥訊
1.日本大鵬HSP90抑制劑在華獲批臨床�����。日本大鵬制藥2.4類新藥pimitespib片獲國家藥監局臨床試驗默示許可,擬用于伊馬替尼耐藥的胃腸道間質瘤(GIST)的治療����。pimitespib(TAS-116)是一款口服熱休克蛋白90(HSP90)抑制劑�����,通過破壞和還原參與癌癥生長和生存的蛋白質(如KIT、PDGFRA�����、HER2和EGFR)���,進而發揮抗腫瘤作用��。2022年6月,日本厚生勞動?��。∕HLW)已批準pimitespib用于治療化療后進展的GIST,商品名為Jeselhy����。
2.邁威新一代ADC報實體瘤IND��。邁威生物抗體偶聯藥物(ADC)1類新藥9MW2921的臨床試驗申請獲CDE受理,擬開發用于實體瘤的治療��。9MW2921可與腫瘤細胞表面的抗原結合并進入腫瘤細胞����,通過特定酶解作用,定向釋放小分子,從而實現對腫瘤的精準殺傷���。在臨床前研究中,9MW2921顯示出積極的腫瘤殺傷作用;并能有效控制靶向相關毒性以及脫靶毒性,具有良好的藥物安全性�����。
3.遠大醫藥引進RDC報膠質瘤IND��。遠大醫藥與Telix International 公司合作開發的放射性核素偶聯藥物(RDC) TLX101(131I-IPA)的新藥臨床試驗(IND)申請獲CDE受理�����,擬開發用于治療多形性膠質母細胞瘤(GBM)。TLX101 (131I-IPA)可自由通過血腦屏障進入大腦����,并靶向膠質母細胞瘤過度表達的L型氨基酸轉運蛋白1(LAT-1)精準輻射癌細胞��,促使其凋亡以達到治療效果。此前���,TLX101已在美國及歐洲獲得孤兒藥認定����。
4.天澤云泰基因療法報IND。上海天澤云泰開發的基因替代療法“VGT-I01”新藥臨床試驗申請獲CDE受理(受理號:CXSL2300080)�。VGR-R01旨在通過回補正確拷貝的CYP4V2基因��,介導RPE細胞表達CYP4V2蛋白。CYP4V2蛋白為P450酶家族成員�����,在視網膜色素上皮細胞(RPE)中高度表達���,具有脂肪酸羥化酶活性�����,與脂肪代謝相關��。這也是天澤云泰申報的第三款基因治療藥物���。
5.創盛橋康引進一款IPF藥物��。創盛橋康(CS Pharmaceuticals)與Daewoong公司達成獨家許可協議,獲得后者臨床早期口服小分子脯氨酰-tRNA合成酶(PRS)抑制劑抗纖維化藥物bersiporocin在大中華區開發和商業化授權�。Bersiporocin已獲得FDA授予治療特發性肺纖維化的孤兒藥資格以及快速通道資格��。根據協議,Daewoong將獲得高達7600萬美元的預付款和開發里程碑付款以及兩位數的凈銷售額分成�,項目交易金額高達3.36億美元���。
國際藥訊
1.Mesoblast公司干細胞療法再報NDA�。Mesoblast公司同種異體間充質干細胞療法Remestemcel-L重新向FDA提交上市許可申請����,用于治療類固醇難治性急性移植物抗宿主病(SR-aGVHD)兒童患者�����。新的臨床數據顯示���,與西奈山醫院數據庫中未接受remestemcel-L治療的兒科患者相比����,接受remestemcel治療的患兒六個月生存率更高(67%vs10%)���。在日本�,remestemcel-L已獲批用于治療患有SR-aGVHD的兒童和成人患者。
2.創新TCR-T療法向FDA滾動遞交NDA�。Adaptimmune公司靶向MAGE-A4抗原的TCR-T細胞療法Afami-cel滾動向FDA提交上市申請����,用于治療晚期滑膜肉瘤�。Afami-cel能夠有效地激活和促進增殖性細胞毒性T細胞浸潤到腫瘤中,有助于抗腫瘤反應�����。公布在CTOS2022年會上的關鍵臨床數據顯示�,afami-cel在滑膜肉瘤患者中的緩解率達到38.6%,中位緩解持續時間為50.3周�����。如果獲批�����,Afami-cel有望成為首款針對實體瘤的TCR-T療法。
3.Karuna公司囊獲多款精神病候選療法�����。Karuna Therapeutics宣布�,從Goldfinch Bio獲得多款擬用于治療多種精神病和神經疾病的TRPC4/5(瞬時受體電位通道4和5)靶向候選療法,其中先導候選療法GFB-887已處于Ⅱ期臨床開發階段。TRPC4/5在先天恐懼功能方面起到重要作用����,是動物對環境應急因子的關鍵反應�����。在臨床前研究中,GFB-887已在情緒和焦慮障礙的臨床前模型中顯示出顯著益處。
4.Alto Neuroscience融資推進四項Ⅱ期臨床���。精神病學藥物公司Alto Neuroscience宣布完成約6000萬美元B輪融資,以用于支持其創新藥物候選療法開展四項Ⅱ期臨床試驗。該公司靶向環磷酸腺苷(cAMP)信號通路的創新藥物組合(ALTO-103和ALTO-104)已在去年12月獲得Ⅰ期研究積極結果;靶向腦源性神經營養因子(BDNF)在研療法ALTO-100也在治療抑郁癥(MDD)的Ⅱa期臨床達到主要研究終點���,顯著降低帶有生物標志物MDD患者的MADRS抑郁量表評分(降低15.5分)。
5.默沙東2022年K藥收入超200億美元。2月2日����,默沙東公布2022年業績報告���,全年超預期營收592.83億美元�����,同比增長22%�,扣除新冠口服藥Lagevrio(莫諾拉韋���,56.84億美元)影響后����,同比增長12%�����。默沙東制藥業務收入520.05億美元�,同比增長22%���;其中PD-1抑制劑Keytruda全年銷售209.37億美元��,同比增長22%�����;HPV疫苗Gardasil/Gardasil 9銷售額約70億美元,同比增長22%��。
6.BioNTech首個質粒DNA制造工廠建成�����。BioNTech公司宣布����,已在德國馬爾堡建設完成首個專有質粒DNA生產工廠����,預計新的生產設施的總投資約為4000萬歐元。質粒DNA制造工廠的建成旨在提高BioNTech在其腫瘤學和COVID-19疫苗管線生產起始材料的靈活性和自主性�����,以及公司因本地生產而在大流行病防范方面的獨立性�。質粒DNA是制造基于mRNA的疫苗和療法以及細胞療法的重要材料�。
醫藥熱點
1.賈偉平院士加盟昆明醫科大學。2月3日���,賈偉平院士授聘為昆明醫科大學名譽教授、昆明醫科大學第一附屬醫院臨床醫學研究中心主任���,授聘儀式在昆醫大附一院報告廳舉行。根據公開信息����,賈偉平����,女�,1956年11月出生,江蘇鎮江人����。1993年畢業于西安醫科大學����,獲碩士學位����,2003年獲上海第二醫科大學博士學位。上海交通大學特聘教授��,博士生導師��,現任上海市糖尿病研究所所長�,國家基層糖尿病防治管理辦公室主任��。
2.北京市疾控局成立���。日前����,北京市衛健委在其官方網站更新領導信息��。信息顯示��,曾曉芃任北京市衛生健康委黨委委員、副主任(兼)�,市疾控局局長��,市疾控中心黨委副書記、主任�。這意味著北京市疾控局已組建成立�。官方公布的簡歷顯示���,曾曉芃專業背景深厚�����,曾主持多項科技部“十五”和“十一五”國家科技攻關和支撐計劃等課題研究與國家標準的制定�����,參與多項國家推薦性標準、行業標準的起草工作。
3.山西增福利減負擔鼓勵生育����。近日�,山西省政府印發《關于優化生育政策促進人口長期均衡發展的實施方案》指出���,嚴格落實產假��、護理假�、育兒假���、哺乳假等制度�,符合政策規定生育子女的���,女方在國家及該省規定產假的基礎上��,獎勵延長產假60日�,男方有護理假15日�����。推動實行父母育兒假制度�����,符合政策規定生育且子女不滿3周歲的,夫妻雙方所在單位分別給予每年不少于15日的育兒假�,并可分別每月發放不低于200元的嬰幼兒保教費���。
評審動態
1. CDE新藥受理情況(02月04日)

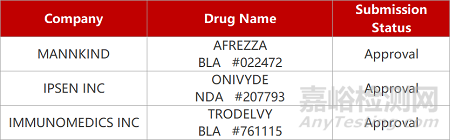
2. FDA新藥獲批情況(北美02月03日)