今日頭條
舒泰神FcRn單抗獲批自免病臨床。舒泰神1類生物藥STSA-1301皮下注射液獲國家藥監局臨床默示許可,擬開發用于治療原發免疫性血小板減少癥 (ITP) 。STSA-1301是一款重組抗人FcRn高親和力人源化IgG4單克隆抗體。通過特異性結合FcRn,使其喪失和IgG結合的能力,加速IgG的降解,同時不影響IgM、IgA等其他類型抗體,從而有望達到治療ITP等致病性IgG自身抗體介導的自身免疫性疾病的目的。
國內藥訊
1.基石PD-L1單抗獲附條件批準新適應癥。基石藥業PD-L1抗體舒格利單抗(擇捷美®)獲國家藥監局附條件批準新適應癥,單藥用于治療復發或難治性結外NK/T細胞淋巴瘤(R/R ENKTL)成人患者。在GEMSTONE-201研究中,舒格利單抗經IRRC評估的ORR達到46.2%,其中完全緩解率達到37.2%。舒格利單抗是全球首個獲批用于R/R ENKTL患者的腫瘤免疫治療藥物,將改變現階段R/R ENKTL患者的治療格局。
2.禮來Aβ單抗中國報產。禮來Aβ單抗donanemab的上市申請獲國家藥監局受理。Donanemab旨在通過與阿爾茨海默病(AD)患者大腦中沉積中的β淀粉樣蛋白結合,以促進大腦中淀粉樣蛋白斑塊的清除。在Ⅲ期TRAILBLAZER-ALZ 2研究中,donanemab治療組患者的iADRS評分和CDR-SB評分的下降速度分別減緩35%和36%,疾病進展速度延緩40%。今年年初,CDE已將Donanemab納入突破性治療品種,用于治療早期癥狀性AD。
3.康寧杰瑞PD-L1獲批子宮內膜癌Ⅲ期臨床。康寧杰瑞皮下注射PD-L1抗體恩沃利單抗(恩維達®)獲FDA批準開展Ⅲ期臨床(KN035-US-004),評估恩沃利單抗聯合侖伐替尼對比卡鉑-紫杉醇化療用于一線治療錯配修復完整(pMMR)晚期或復發性子宮內膜癌患者的有效性與安全性。在美國,該新藥還曾獲得FDA授予的用于治療晚期膽道癌及治療軟組織肉瘤的2項孤兒藥資格。
4.艾力斯EGFR-TKI獲肺癌突破性療法認定。艾力斯醫藥自主研發第三代EGFR-TKI創新藥伏美替尼片獲FDA突破性療法認定,用于一線治療EGFR 20外顯子插入突變的局部晚期或轉移性非鱗狀非小細胞肺癌(NSCLC)患者。公布于WCLC2023年會上的Ⅰb期臨床(FAVOUR)結果顯示,經IRC評估,初治240mg組、經治240mg組、經治160mg組的確證客觀緩解率(ORR)分別為78.6%、46.2%、38.5%,中位緩解持續時間(DoR)分別為15.2個月、13.1個月、9.7個月。
5.恒瑞源正細胞療法獲批Ⅱ期臨床。恒瑞源正1類生物制品多抗原自體免疫細胞注射液(MASCT-I)獲國家藥監局批準開展Ⅱ期臨床,評價MASCT-I聯合多柔比星和異環磷酰胺一線治療晚期軟組織肉瘤患者的有效性和安全性。MASCT-I的活性成份包括負載多種腫瘤相關抗原的DC細胞以及DC細胞活化擴增的自體效應T淋巴細胞。目前,MASCT-I也正在Ⅱ期臨床中評估用于治療尿路上皮癌的潛力。
國際藥訊
1.諾華ETAR抑制劑IgA腎病III期臨床積極。諾華高選擇性內皮素A(ETA)受體抑制劑Atrasentan治療IgA腎病的III期ALIGN研究達到主要終點。期中結果顯示,與安慰劑相比,Atrasentan治療組患者36周時蛋白與肌酐濃度比(UPCR)較基線的變化具有統計學意義的改善,患者的蛋白尿顯著減少;其安全性與既往研究一致。諾華計劃基于中期數據向FDA尋求加速批準上市。
2.葛蘭素史克PD-1抗體子宮內膜癌Ⅲ期臨床成功。葛蘭素史克PD-1抑制劑Jemperli(dostarlimab)聯合標準化療(卡鉑和紫杉醇)、之后Jemperli單藥的一線方案,在治療原發性晚期或復發性子宮內膜癌的Ⅲ期臨床RUBY達到總生存期(OS)的主要終點。在兩個預定的亞群中(dMMR/MSI-H和MMRp/MSS),Jemperli組合均顯著提高患者的OS。此前,該組合已達到無進展生存期(PFS)的主要終點,在dMMR/MSI-H亞群和總體患者群中分別降低72%和36%的疾病進展或死亡風險。此外,藥物的安全性與已知研究一致。
3.大冢多動癥新藥兩項Ⅲ期臨床積極。大冢制藥潛在“first-in-class”療法centanafadine治療注意力缺陷/多動障礙的兩項Ⅲ期臨床均達到主要終點。與安慰劑相比,centanafadine治療均能顯著改善青少年(13-17歲)和兒童(6-12歲)患者的ADHD-RS-5量表評分,且藥物安全性良好。Centanafadine是Neurovance公司(已被大冢制藥收購)開發的一種甲腎上腺素、多巴胺和5-羥色胺再攝取抑制劑(NDSRI)。
4.CSF1R激酶抑制劑TGCT關鍵Ⅲ期臨床成功。Deciphera公司口服CSF1R激酶抑制劑vimseltinib治療腱鞘巨細胞瘤(TGCT)患者的Ⅲ期(MOTION)試驗達到主要和所有關鍵次要終點。在意向治療(ITT)人群中,vimseltinib治療組和安慰劑組第25周時的客觀緩解率分別為40%(95% CI:29%-51%)和0%(95% CI:0%-9%),組間差異為40%(95% CI:29%-51%,p<0.0001);藥物的安全性與之前研究一致。該公司計劃明年向FDA和歐盟遞交上市申請。
5.補體C3療法眼科Ⅲ期臨床見刊《柳葉刀》。Apellis公司在《柳葉刀》上發表其靶向C3補體蛋白的聚乙二醇化(PEGylated)雙環肽療法Syfovre(pegcetacoplan)治療繼發于年齡相關性黃斑變性(AMD)的地圖樣萎縮(GA)的Ⅲ期(OAKS和DERBY)研究積極結果。數據顯示,每隔一個月和每月一次的Syfovre治療均能顯著減少GA病變的生長。今年2月,FDA已批準Syfovre用于治療由AMD引起的地圖樣萎縮(GA)。
6.DMD基因療法Ⅲ期驗證臨床失敗。Sarepta公司治療杜氏肌營養不良(DMD)的基因療法Elevidys在Ⅲ期驗證性臨床EMBARK中未達到主要終點。與安慰劑組相比,Elevidys治療組患者的與運動功能相關的NSAA評分顯示改善趨勢,但不具統計學意義;而次要終點TTR和10MWR指標的統計則顯著改善。今年6月,基于Elevidys在臨床試驗中顯著提高患者肌肉中微抗肌萎縮蛋白的表達水平的替代終點結果,FDA已加速批準Elevidys上市。
醫藥熱點
1.輝瑞將裁員近800人。10月30日,根據新澤西州發布的《工人調整和再培訓通知》(WARN),輝瑞將在新澤西州格拉德斯通裁員791人。這輪裁員計劃預計將于2024年2月生效。10月16日,輝瑞因新冠業務下滑而下調了2023全年指引,將今年收入預期下調至580億至610億美元,比之前發布的指導性目標減少90億美元。
2.浙江中醫藥大學富春校區開工。近日,浙江中醫藥大學富春校區建設工程開工。這是浙江省重點建設項目、擴大有效投資“千項萬億”工程重大項目和公共服務“七優享”(學有優教)工程重大項目。項目總用地面積679.83畝,總建筑面積325000平方米。項目建成后,浙江中醫藥大學總部將搬遷至富春校區,進一步拓展辦學空間、提升辦學條件,助力建設一流中醫藥大學。
3.復旦大學團隊發布醫生科普評價報告。據復旦大學發展研究院10月27日消息,復旦大學新聞學院孫少晶教授團隊和復旦大學發展研究院王帆研究員團隊歷時半年多,通過對抖音、微博、微信三大社交媒體平臺健康科普內容的抽樣分析,完成《數字時代中國醫生健康科普評價報告》。報告顯示,在三個平臺中,關于慢性疾病與生活方式的健康科普內容比較豐富,而心理健康等隱性健康話題的可見性與關注度明顯不足。在閱讀量較高的內容中,日常保健與疾病分析占比較高,癌癥、中醫藥知識內容占較大比例,而心理疾病、疫苗等主題的內容相對較少。
評審動態
1. CDE新藥受理情況(10月31日)
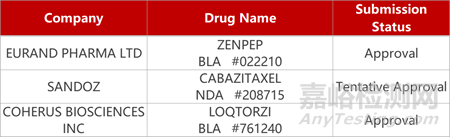
2. FDA新藥獲批情況(北美10月27日)