您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2022-11-10 01:57
江蘇省一次性使用腔鏡用直線型切割吻合器技術審評要點
本審評要點旨在為技術審評部門審核注冊申報資料時把握重點,統一審評尺度,同時指導江蘇省內注冊申請人對注冊申報資料的準備及撰寫。本審評要點不涉及注冊審批等行政事項,亦不作為法規強制執行。
本審評要點系對一次性使用腔鏡用直線型切割吻合器的一般要求,應依據產品的具體特性確定其中內容是否適用,若不適用,查看申請人是否闡述理由并提交相應的依據。本審評要點未涵蓋的產品特殊性能要求,查看申請人是否依據產品特性進行了充分研究并提交相關注冊申報資料。
本審評要點是在現行法規、標準體系及當前認知水平下制定的,隨著法規、標準體系的不斷完善和科學技術的不斷發展,相關內容也將適時進行調整。
一、要點適用范圍
本審評要點適用于吻合釘呈六排互相平行錯位排列的二類無源的一次性使用腔鏡用直線型切割吻合器及組件,新型結構設計、新型作用機理除外。
二、申請表
(一)產品名稱
產品名稱為一次性使用腔鏡用直線型切割吻合器或一次性使用腔鏡用直線型切割吻合器及組件(以下簡稱吻合器)。
(二)產品適用范圍
根據臨床評價資料明確適用范圍,如“適用于開放或內鏡下的外科手術中,肺、支氣管組織及胃、腸切除、橫斷和吻合”。
(三)規格型號
規格型號與技術要求等資料中完全一致。
(四)申請人基本信息
企業名稱、住所、統一社會信用代碼等應與營業執照一致。
(五)結構組成
結構組成應與技術要求、說明書等資料中完全一致。
三、證明性文件
應有營業執照副本復印件。
四、醫療器械安全有效基本要求清單
清單表格第3列若適用,應注明“是”。不適用應注明“否”,并說明不適用的理由。
清單表格第4列應當填寫證明該醫療器械符合安全有效基本要求的方法,通常可采取下列方法證明符合基本要求:
(一)符合已發布的醫療器械部門規章、規范性文件。
(二)符合醫療器械相關國家標準、行業標準、國際標準。
(三)符合普遍接受的測試方法。
(四)符合企業自定的方法。
(五)與已批準上市的同類產品的比較。
(六)臨床評價。
為符合性提供的證據需標明在注冊申報資料中的位置和編號。對于包含在產品注冊申報資料中的文件,需說明其在申報資料中的具體位置。例如:十、注冊檢驗報告;說明書第11章。對于未包含在產品注冊申報資料中的文件,應當注明該證據文件名稱及其在質量管理體系文件中的編號備查。
五、綜述資料
(一)概述
吻合器的管理類別為二類,分類編碼為02-13。
(二)產品描述
工作原理:吻合器通過機械傳動裝置,將預先放置在組件中呈六排互相平行錯位排列的吻合釘,擊入已經對合好需要吻合在一起的組織內,吻合釘在穿過組織后受到前方抵釘座阻擋,向內彎曲,形成類“B”形互相錯位排列,將組織吻合在一起。由于小血管可以從“B”形吻合釘空隙中通過,故不影響吻合部位及其遠端的血液供應。
結構組成:應和產品技術要求等資料中描述一致,吻合器通常由器身和組件兩部分組成,分別描述器身和組件的組成。
主要原材料:描述該產品各個結構的原材料。
(三)型號規格
吻合器通常由器身和組件兩部分組成,可分別描述器身和組件的型號規格;若產品存在不同的型式,應當關注各型號規格的區別。
應當關注各種型號規格的結構組成、功能、產品特征、性能指標等方面的差異。
應當關注上述描述應與技術要求、說明書中完全一致。
(四)包裝說明
應當關注產品包裝的類型、材質等,以及與該產品一起銷售的配件包裝情況,以及最小包裝、中包裝、大包裝的信息。
(五)適用范圍和禁忌癥
1.適用范圍:根據臨床評價資料明確適用范圍,如“適用于開放或內鏡下的外科手術中,肺、支氣管組織及胃、腸切除、橫斷和吻合”。
2.預期使用環境:醫療機構。
3.適用人群:成人、兒童。
4.禁忌癥:不得應用于:血管吻合、缺血或壞死組織、炎癥、粘膜水腫及腫瘤部位、切端疑有癌組織殘留。其余參照臨床評價資料補充。
(六)其他需說明的內容。
六、研究資料
(一)產品性能研究
應當提供產品性能研究資料以及產品技術要求的研究和編制說明,包括功能性、安全性指標以及與質量控制相關的其他指標的確定依據,所采用的標準或方法、采用的原因及理論基礎。
依據:《腔鏡用吻合器產品注冊技術審查指導原則》、YY 0876-2013 直線型切割吻合器及組件。
關注點:
1.吻合釘材料
應提供吻合釘供貨合同及供應商出廠檢測報告等,若吻合釘原材料是鈦絲,檢測報告中化學成分應符合GB/T 13810-2017,若吻合釘原材料是鉭絲,化學成分應符合ISO13782或YY/T 0966-2014。制成吻合釘材料的拉伸強度應不小于240MPa。如對吻合釘原材料進行改性處理,應說明。
2.靈活性
吻合器開閉應靈活,不應有卡阻現象。
3.裝配性
吻合器組件更換方便,定位可靠。組件經甩動后吻合釘不應露出釘倉表面。
4.鋒利度
切割刀刃口應鋒利,切割力應不大于0.8N。
5.吻合和切割性能
吻合器應具有良好的吻合和切割性能,更換組件,作不少于5次切割吻合,其每次吻合后的縫釘應成類“B”字形,同時每次吻合后的切割邊緣應整齊,無毛邊,每次吻合線長度比切割線長度至少長1.5倍釘長。
6.耐壓性能
吻合后的吻合口應能承受不小于3.6kPa壓強,在15s內漏水不超過10滴。
7.安全裝置
吻合器應具有空釘倉安全保護裝置,并保持其可靠性。
8.表面粗糙度
吻合器金屬件表面粗糙度Ra應不大于0.8µm。
9.使用性能
(1)吻合器器身與組件連接應牢固可靠。
(2)彎轉型吻合器,擺動到最大角度(明確具體角度及
允差)后,能順利完成擊發和復位。
(3)吻合器應具有擊發過程反饋指示裝置,能夠指示擊發過程或狀態。
10.硬度
切割刀硬度應不低于377HV0.2。
11.耐腐蝕性能
吻合器頭端外表面金屬件部分的耐腐蝕性能應不低于 YY/T 0149-2006中5.4 b)的規定。
12.包裝密封
(1)吻合器及組件的包裝應完好,粘合密封區域應無通道或穿孔。
(2)吻合器及組件的包裝封口剝離強度不小于0.1N/mm;剝離后兩接觸表面應光滑且連續均勻,無分層或撕裂現象。
13.外觀
(1)吻合器外形光滑、輪廓清晰、無毛刺、劃傷等缺陷。
(2)吻合器外表面上的字跡、標志清晰、不得有錯位、歪斜等缺陷。
(3)吻合器表面不得有毛刺、凹陷等缺陷。
14.尺寸
吻合器及組件尺寸應符合制造商的規定。
15.滅菌
吻合器及組件應經已確認過的滅菌過程(明確滅菌方式)進行滅菌,產品應無菌。
16.環氧乙烷殘留量
若采用環氧乙烷滅菌,環氧乙烷殘留量≤10μg/g。
17.按照《腔鏡用吻合器產品注冊技術審查指導原則》研究閉合力、夾持力及其均勻性、抵釘座與釘倉的安全間隙等,并提交驗證報告。
18.若組件可更換,需提交組件可更換最大次數的驗證報告,驗證次數需超過制造商規定的最大次數。
(二)生物相容性評價研究
應對產品中與患者和使用者直接或間接接觸的材料的生物相容性進行評價。
生物相容性評價研究資料應當包括:
1.生物相容性評價的依據和方法
生物學評價依據GB/T 16886.1-2011、YY 0876-2013開展。
2.產品所用材料的描述及與人體接觸的性質
產品按人體接觸性質分類:除吻合釘之外,產品為外部接入器械b組織(與組織接觸的器械);按接觸時間分類為短期接觸(在24小時以內一次,多次或重復使用或接觸的器械)。明確吻合釘的材質,表面是否改性處理,吻合釘為植入器械(接觸組織);按接觸時間分類為持久接觸(>30d)。吻合釘,選用表面作改性處理的純鈦、鈦合金材料和純鉭材料,應按GB/T 16886.1-2011的規定進行生物學評價。
3.實施或豁免生物學試驗的理由和論證
產品可以用成品或原材料進行生物學試驗,使用原材料生物學試驗報告用于豁免成品生物學試驗的企業應關注是否提供原材料在生產加工過程中沒有進行改性處理的聲明。
4.對于現有數據或試驗結果的評價。
根據有資質的檢驗機構出具的檢驗報告,生物學評價應符合要求。
(三)滅菌工藝研究
查看滅菌/消毒確認報告,重點關注滅菌工藝(方法和參數)和無菌保證水平(SAL)。
(四)產品有效期和包裝研究
查看有效期和包裝驗證報告,重點關注以下內容:
吻合器與組件分開包裝的,應分別對其有效期和包裝進行研究。
1.有效期:期限、加速老化或實時老化的試驗方法及結論。
2.包裝及包裝完整性:根據產品的包裝材質,關注是否有合適的包裝完整性試驗,如無菌實驗、真空泄漏實驗、染料滲漏試驗、瓊脂接觸攻擊試驗、密封強度測試等,并進行外包裝抗壓、跌落、模擬運輸等測試,并有試驗結論。
(五)其他資料
證明產品安全性、有效性的其他研究資料。
七、生產制造信息
應關注工藝流程圖,應標明關鍵工序、特殊工藝、委外工序等。
吻合釘若選用表面改性處理(涂層、酸蝕等)的金屬材料(如純鈦、鈦合金材料、純鉭等),需要給出改性層或涂層的元素成分、組織結構、理化性能、結合強度等信息及其相關的制備工藝。
八、臨床評價資料
應關注是否依據《醫療器械臨床評價技術指導原則》提交臨床評價資料。
九、產品風險分析資料
參照YY/T 0316進行風險分析,不存在不可接受級別的風險項,所有的剩余風險都是可以接受的。
十、產品技術要求
醫療器械產品技術要求應當按照《醫療器械產品技術要求編寫指導原則》的規定編制。
應根據產品自身的特點制定相應的技術要求,但性能指標不得低于相關國家標準、行業標準的有關要求,如有不適用條款,應說明理由。產品技術要求中應明確規格型號的劃分、產品的結構組成等內容。
技術要求舉例詳見附件。
十一、產品注冊檢驗報告
按國家/省藥監部門最新規定查看檢驗報告。
所檢驗型號產品應當是本注冊單元內能夠代表申報的其他型號產品安全性和有效性的典型產品,若一個型號不能覆蓋,除選擇典型型號進行全性能檢驗外,還應選擇其他型號進行差異性檢驗。
一個注冊單元中含有等高型和不等高型的吻合釘,應選擇帶不等高型吻合釘的型號規格進行檢測,如頭端可彎轉,應選擇可彎轉的型號進行檢測。
不同材質應分別檢測相關性能。
十二、產品說明書和最小銷售單元的標簽樣稿
產品說明書和標簽應符合《醫療器械說明書和標簽管理規定》的要求。
(一)說明書應包括如下內容:
說明書開頭部分建議給予“使用前請仔細閱讀說明書全部內容,不仔細按說明操作將會導致嚴重的手術后果,如吻合口裂開或滲漏”的提示。
1.產品名稱、型號、規格;
2.注冊人的名稱、住所、聯系方式及售后服務單位;
3.生產企業的名稱、住所、生產地址、聯系方式及生產許可證編號;
4.醫療器械注冊證/產品技術要求編號;
5.產品性能、主要結構組成、適用范圍;
6.禁忌癥、注意事項;
7.警示以及提示的內容,舉例如下:
(1)微創操作應由受過足夠訓練與熟悉微創技術的人實施。在實施任何微創術前應查閱與該技術及其并發癥及危害有關的醫學文獻。
(2)不同廠家之間的微創設備的尺寸可能各不相同。一個手術中如果同時應用不同廠家生產的微創手術器械及其附件,在手術前要核實其是否相兼容。
(3)手術前放療可能導致組織改變。例如,這些改變可能引起組織增厚而超出所選吻合釘的指定范圍。任何對病人手術前的治療都應經過仔細考量,可能需要更改手術技術或手術方式。
(4)直到器械準備好要擊發,方可釋放保險裝置。
(5)擊發前一定要檢查抵釘座的安全性。
(6)擊發后一定要檢查吻合線處止血情況、檢查吻合是否完整及有無滲漏。
(7)確保組織厚度在指定范圍內、組織在吻合器內均勻分布。一側組織過多可引起吻合不佳,可能會發生吻合口滲漏。
(8)在組織過多或組織過厚的情況下,試圖用力擊發扳機可能導致縫合線不完整,有可能吻合口裂開或滲漏。此外,可能發生器械損壞或擊發失敗。
(9)一次擊發必須完成。切勿部分擊發器械。不完全擊發可能導致吻合釘成型不正常、切割線不完全、出血并從縫合線滲漏、和/或移除器械困難。
(10)一定要擊發到底,以確保縫釘正確成型及組織切割正確。
(11)擠壓擊發扳機會暴露出刀片。切勿反復按壓擊發桿,這樣會導致吻合部位損傷。
(12)在插入裝置時,確保保險處于關閉位置以避免擊發桿不慎啟動,導致刀片意外暴露及吻合釘過早的部分或全部展開。
(13)接觸過體液的器械應特別處置以防生物污染的發生。
(14)器械或裝置一經打開,不論使用與否,不得再次滅菌使用。處理前要確保鎖上保險。
(15)本產品是滅菌包裝,僅限使用一次。多名患者使用可能危及產品的完整性,或存在受污染的風險,進而可能會導致患者傷害。
(16)說明吻合器的最大擊發次數,給出“更換次數請勿超過最大擊發次數”,及“將本器械與吻合線加固材料一起使用可能會使擊發次數降低”的警示。
8.安裝和使用說明或者圖示(建議采用文字與圖示相結合說明使用步驟)及各步驟應注意的情況;
應提示使用者注意該器械與附件(釘倉)的兼容性。
應明確MRI磁共振兼容性及限定MRI使用條件。
9.產品維護和保養方法,特殊儲存、運輸條件、方法;
10.生產日期,使用期限或者失效日期;
11.配件清單,包括配件、附屬品、損耗品更換周期以及更換方法的說明等;
12.醫療器械標簽所用的圖形、符號、縮寫等內容的解釋;
13.說明書的編制或者修訂日期;
14.其他應當標注的內容。
(二)醫療器械標簽一般應當包括以下內容:
1.產品名稱、型號、規格;
2.注冊人的名稱、住所、聯系方式;
3.醫療器械注冊證編號;
4.生產企業的名稱、住所、生產地址、聯系方式及生產許可證編號;
5.生產日期,使用期限或者失效日期;
6.根據產品特性應當標注的圖形、符號以及其他相關內容;
7.必要的警示、注意事項;應標明滅菌方式;
8.儲存,操作條件及說明;
醫療器械標簽因位置或者大小受限而無法全部標明上述內容的,至少應當標注產品名稱、型號、規格、生產日期和使用期限或者失效日期,并在標簽中明確“其他內容詳見說明書”。
十三、符合性聲明
(一)符合性聲明:聲明本產品符合《醫療器械注冊管理辦法》和相關法規的要求;聲明本產品符合《醫療器械分類規則》有關分類的要求;聲明本產品符合現行國家標準、行業標準,并提供符合標準的清單。
(二)申請材料的真實性保證聲明。
(三)申請企業承諾。
注:以上表格可至“江蘇政務服務”官網下載。
附件:一次性使用腔鏡用直線型切割吻合器及組件技術要求參考模板
附件
醫療器械產品技術要求
醫療器械產品技術要求編號:XXXXXXXXX
一次性使用腔鏡用直線型切割吻合器及組件
1.產品型號/規格及其劃分說明
1.1組成
一次性使用腔鏡用直線型切割吻合器及組件(以下簡稱吻合器)由器身和組件組成。吻合器根據切割刀設計,分為切割刀裝配于組件型和切割刀裝配于器身型;根據關節結構,分為彎轉型和不可彎轉型。
切割刀裝配于組件型腔鏡切割吻合器,器身一般由擊發桿、桿、關節頭旋鈕、旋轉軸環、擊發按鈕、回復鈕、卸載按鈕、手柄等組成;組件一般由抵釘座、釘倉、釘倉座、切割刀和吻合釘等組成。
切割刀裝配于器身型腔鏡切割吻合器,器身一般由抵釘座、關節頭、桿、旋轉鈕、調節撥片、刀片方向切換鈕、擊發指示窗、刀片方向指示窗、釋放鈕、手柄、關閉手柄、擊發手柄、切割刀、釘倉座等組成;組件一般由釘倉和吻合釘等組成。
1.2型號/規格
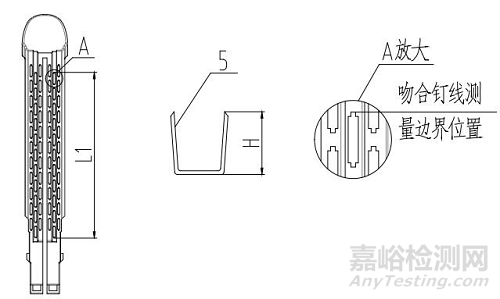
器身可根據器身桿長度、切割長度或吻合長度等劃分為不同的型號規格,組件可根據吻合長度、釘高尺寸等劃分為不同的規格;
1.3產品的基本型式見圖1-4,尺寸見表1、表2。
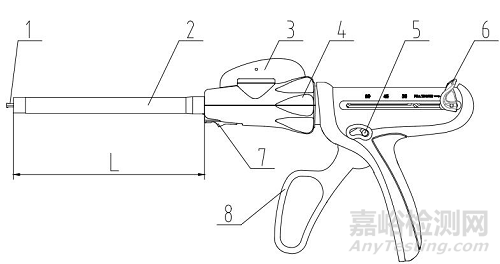
1、擊發桿;2、桿;3、關節頭旋鈕;4、旋轉軸環;5、擊發按鈕;6、回復鈕;7、卸載按鈕;8、手柄
圖1 吻合器器身(切割刀裝配于組件型)結構示意圖
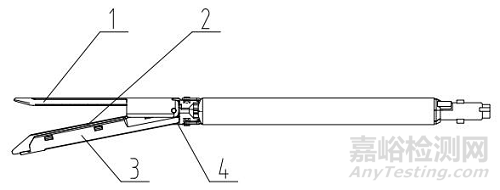
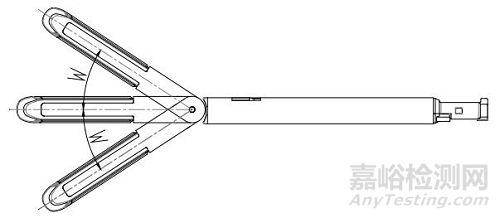
1、抵釘座;2、釘倉;3、釘倉座;4、切割刀;5、吻合釘
圖2 組件(切割刀裝配于組件型)結構示意圖
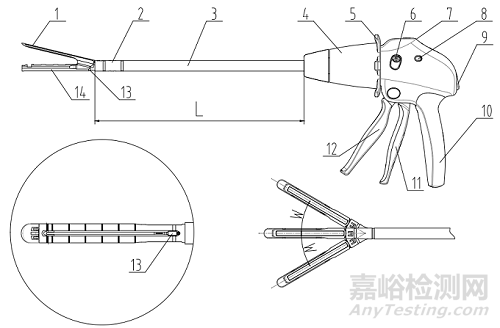
1、抵釘座;2、關節頭;3、桿;4、旋轉鈕;5、調節撥片;6、刀片方向切換鈕;7、擊發指示窗;8、刀片方向指示窗;9、釋放鈕;10、手柄;11、關閉手柄;12、擊發手柄;13、切割刀;14、釘倉座
圖3 吻合器器身(切割刀裝配于器身型)結構示意圖
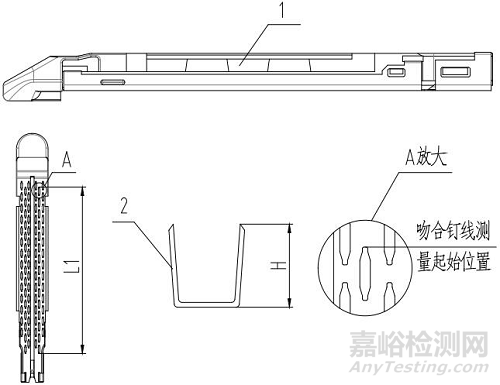
1、釘倉;2、吻合釘
圖4 吻合器組件(切割刀裝配于器身型)結構示意圖
表1 器身規格尺寸(mm)
|
器身型號規格 |
L |
允差 |
|
…… |
|
±5.0 |
備注:尺寸可由企業自行設計。
表2 組件規格尺寸(mm)
|
組件型號規格 |
吻合長度L1 |
允差 |
吻合釘高度H |
允差 |
|
|
||||
|
(內、中、外) |
||||
|
…… |
|
±2.0 |
|
±0.2 |
備注:尺寸可由企業自行設計。
1.4產品的結構組成
表3 關鍵零件材料要求
|
零件名稱 |
材料牌號 |
標準號 |
|
吻合釘 |
|
|
|
抵釘座 |
|
|
|
…… |
|
|
2. 性能指標
2.1吻合釘材料
2.1.1制成吻合釘的純鈦、鈦合金材料的化學成分應符合GB/T 13810-2017的規定。
2.1.2制成吻合釘材料的拉伸強度應不小于240MPa。
2.2靈活性
吻合器開閉應靈活,不應有卡阻現象。
2.3裝配性
2.3.1吻合器組件更換方便,定位可靠。
2.3.2組件經甩動后吻合釘不應露出釘倉表面。
2.4鋒利度
切割刀刃口應鋒利,切割力應不大于0.8N。
2.5吻合和切割性能
2.5.1吻合器應具有良好的吻合和切割性能,更換組件,作不少于5次切割吻合,其每次吻合后的縫釘應成類“B”字形。
2.5.2同時每次吻合后的切割邊緣應整齊,無毛邊。
2.5.3每次吻合線長度比切割線長度至少長1.5倍釘長。
2.6耐壓性能
吻合后的吻合口應能承受不小于3.6kPa壓強,在15s內漏水不超過10滴。
2.7安全裝置
吻合器應具有空釘倉安全保護裝置,并保持其可靠性。
注:空釘倉指被擊發過的組件。
2.8表面粗糙度
吻合器金屬件表面粗糙度Ra應不大于0.8µm。
2.9使用性能
2.9.1吻合器器身與組件連接應牢固可靠。
2.9.2彎轉型吻合器,擺動到最大角度(明確具體角度及允差)后,能順利完成擊發和復位。
2.9.3吻合器應具有擊發過程反饋指示裝置,能夠指示擊發過程或狀態。
2.10硬度
切割刀硬度應不低于377HV0.2。
2.11耐腐蝕性能
吻合器頭端外表面金屬件部分的耐腐蝕性能應不低于YY/T 0149-2006中5.4 b)的規定。
2.12包裝密封
2.12.1吻合器及組件的包裝應完好,粘合密封區域應無通道或穿孔。
2.12.2吻合器及組件的包裝封口剝離強度不小于0.1N/mm;剝離后兩接觸表面應光滑且連續均勻,無分層或撕裂現象。
2.13外觀
2.13.1吻合器外形光滑、輪廓清晰、無毛刺、劃傷等缺陷。
2.13.2吻合器外表面上的字跡、標志清晰、不得有錯位、歪斜等缺陷。
2.13.3吻合器表面不得有毛刺、凹陷等缺陷。
2.14尺寸
吻合器及組件尺寸應符合表1-2的規定。
2.15滅菌
吻合器及組件應經已確認過的滅菌過程(此處明確滅菌方式)進行滅菌,產品應無菌。
2.16環氧乙烷殘留量
若采用環氧乙烷滅菌,環氧乙烷殘留量≤10μg/g。
3. 檢驗方法
3.1吻合釘材料
3.1.1制成吻合釘的純鈦和鈦合金材料的化學成分檢驗按GB/T 13810-2017規定的方法進行試驗,應符合2.1.1的規定。
3.1.2吻合釘材料的拉伸強度按GB/T 228.1-2010規定的方法進行試驗,應符合2.1.2的規定。
3.2靈活性
仿使用動作,合上及打開吻合器,應符合2.2的規定。
3.3裝配性檢驗
3.3.1更換組件,應符合2.3.1的規定。
3.3.2甩動組件至少5次后,用手觸摸釘倉表面,應符合2.3.2規定。
3.4鋒利度
按YY 0876-2013附錄A方法進行,應符合2.4的規定。
3.5吻合和切割性能
吻合兩層總厚度為釘高的1/2?2/3的EVA低發泡板試樣(參照YY 0876-2013附錄B)。沿成型吻合釘邊緣去除多余EVA低發泡板,露出成型后的吻合釘,目視檢查,應符合2.5的規定。
3.6耐壓性能
按YY 0876-2013附錄C方法進行,應符合2.6的規定。
3.7安全裝置
將吻合器裝上已擊發過的空釘倉,調整吻合器進行擊發動作時,應符合2.7的規定。
3.8表面粗糙度
表面粗糙度用樣塊比較法或GB/T 10610-2009規定的輪廓法進行,應符合2.8的規定。仲裁時采用輪廓法。
3.9使用性能
3.9.1由制造商根據產品確定,符合2.9.1的規定。
3.9.2仿使用動作使吻合器釘倉關節分別擺動到左極限和右極限位置,應符合2.9.2的規定。
3.9.3仿使用動作擊發吻合器,應符合2.9.3的規定。
3.10硬度
按GB/T 4340.1-2009中規定的方法進行,應符合2.10的規定。
3.11耐腐蝕性能
按YY/T 0149-2006中沸水試驗法進行試驗,應符合2.11的規定。
3.12包裝密封
3.12.1密封性能試驗
按YY 0876-2013附錄D方法進行測試,應符合2.12.1的規定。
3.12.2剝離強度試驗
按YY 0876-2013附錄E方法進行,應符合2.12.2的規定。
3.13外觀
目視檢查并用手拭摸,應符合2.13的規定。
3.14尺寸檢驗
用通用量具或專用量具測量,應符合2.14的規定。
3.15無菌
按中華人民共和國藥典(2020 年版·四部)“無菌檢查法”進行試驗,應符合2.15的規定。
3.16環氧乙烷殘留量
按GB/T 16886.7-2015中規定的方法進行試驗,應符合2.16的規定。

來源:江蘇省藥品監督管理局審


