您當前的位置:檢測資訊 > 生產品管
嘉峪檢測網 2020-11-11 08:54
為貫徹落實《疫苗管理法》和《藥品管理法》有關要求,2020年7月1日,廣受社會各界關注的新版GMP附錄《生物制品》正式施行了,這是距離上次版本實施時間(2011年3月1日實施)已時隔9年,也是2019年12月1日起實施史上“最嚴”的《疫苗管理法》后監管部門史上“最嚴”生物制品GMP附錄,進一步完善了生物制品監管長效機制,筆者梳理了生物制品的一些冷知識,個人觀點,不足之處,請提出您的意見,共享知識。
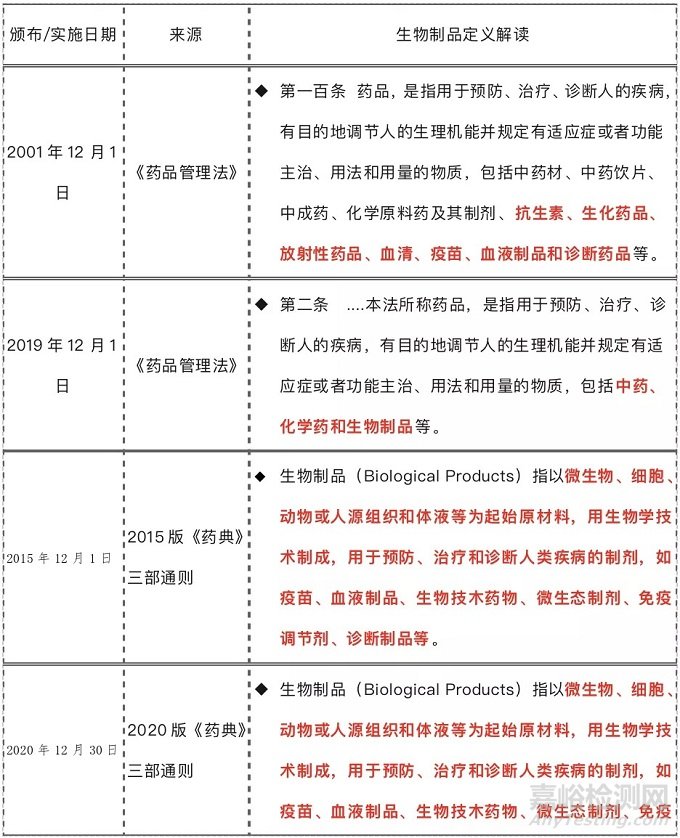
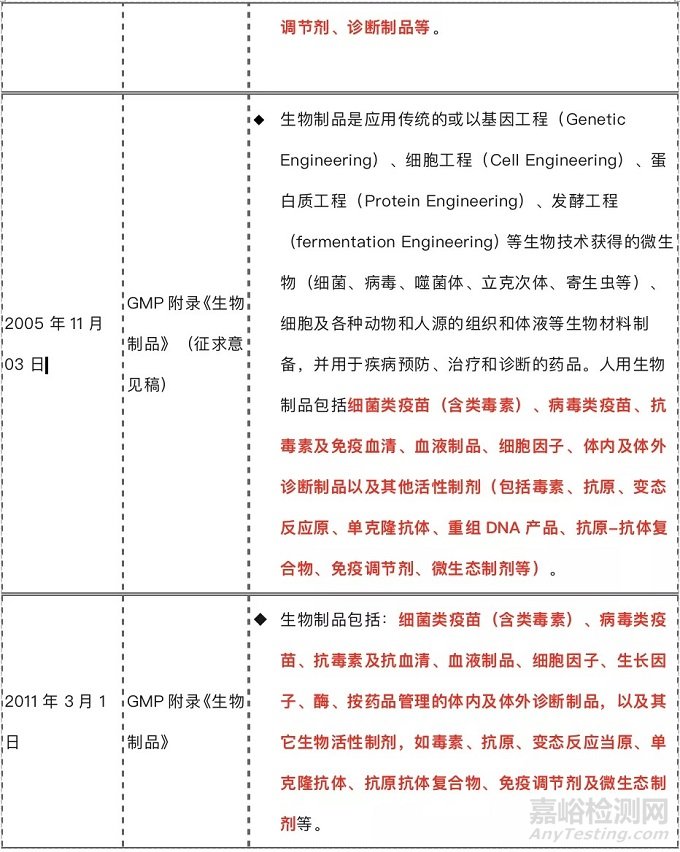
生物制品定義
生物制品作為藥品的一種,在新《藥品管理法》實施之前,我們常述的“生物制品”為抗生素、生化藥品、放射性藥品、血清、疫苗、血液制品和診斷藥品等藥品的統稱,新《藥品管理法》實施后,明確將藥品包括中藥、化學藥和生物制品等,關于生物制品的定義和2017年9月1日起施行的GMP另一家族《生化藥品》概念很容易混淆,對這個專業術語的來源進行了檢索,梳理了一下定義:

生物制品分類
生物制品根據定義來基本可了解它的分類情況,一般來講,目前主要有從以下兩方面進行分類,分別是根據用途及作用分類。
1、根據用途分類
(1)治療藥物如治療腫瘤的白介素-2;用于內分泌疾病治療的藥物胰島素、生長素;用于心血管系統疾病治療的藥物如血管舒緩素、彈性蛋白酶等;用于血液和造血系統的藥物如尿激酶、水蛭素、凝血酶、凝血因子vin和IX、組織纖溶酶原激活劑、促紅細胞生成素等;
抗病毒藥物如干擾素等。
(2)預防藥物:主要是疫苗,如新冠肺炎疫苗、乙肝疫苗、禽流感疫苗等。
(3)診斷藥物:絕大部分臨床診斷試劑都來自生物制品,如流感病毒診斷診斷試劑盒、如艾滋病診斷試劑盒等。
2、按作用類型分類
(1)細胞因子類藥物:如白細胞介素、干擾素、集落刺激因子、腫瘤壞死因子及生長因子等。
(2)激素類藥物:如人胰島素、人生長激素等。
(3)酶類藥物:如胃蛋白酶、尿激酶等。
(4)疫苗:如新冠肺炎疫苗、乙肝疫苗、禽流感疫苗等。
(5)單克隆抗體藥物:如利妥昔單抗、曲妥珠單抗、阿侖珠單抗等。
(6)反義核酸藥物:如福米韋生(fomivirsen)等。
(7)RNA:干擾(RNAi)藥物。
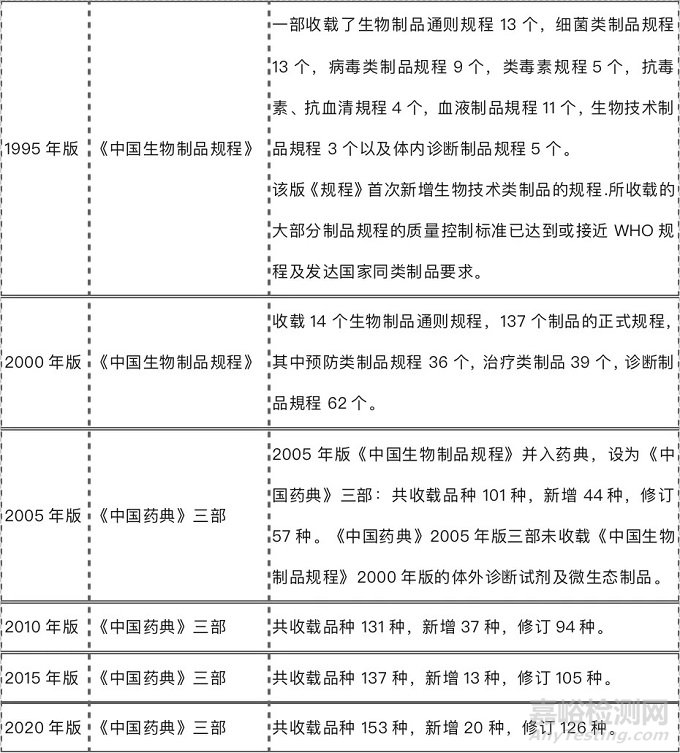
中國生物制品標準的沿革情況
生物制品國家標準是對生物制品生產工藝、質最標準和檢定方法的技術規范.是生物制品生產、供應、使用和監管共同遵守的法定依據。
新中國頒布的第一部生物制品國家標準是1952年版《生物制品法規》、歷經《生物制品制造檢定規程》1959年版,《生物制品規程》1979年版,《中國生物制品規程》1990年版、1995年版、2000年版,2005年版《中國生物制品規程》并入藥典,設為《中國藥典》三部、歷經2005年版、2010年版、2015年版、2020年版。
新中國自1952年頒布的第一部生物制品國家標準以來,歷經10個版本更新,各版本收載生物制品情況如下表所示:

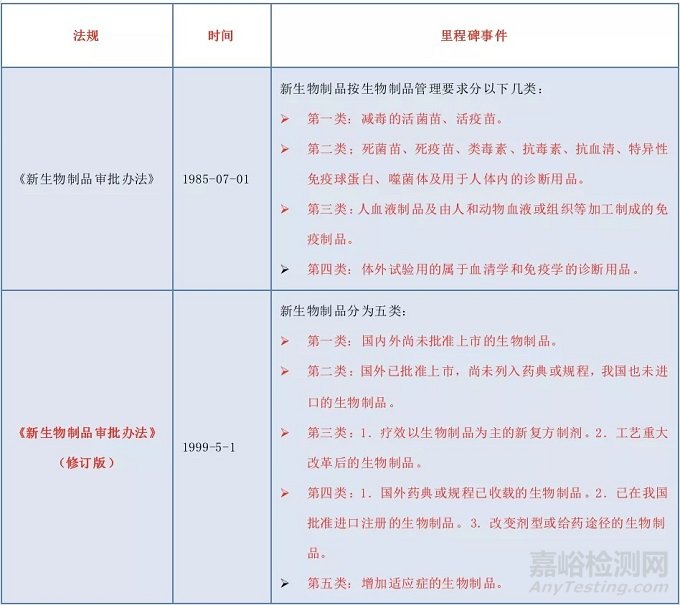
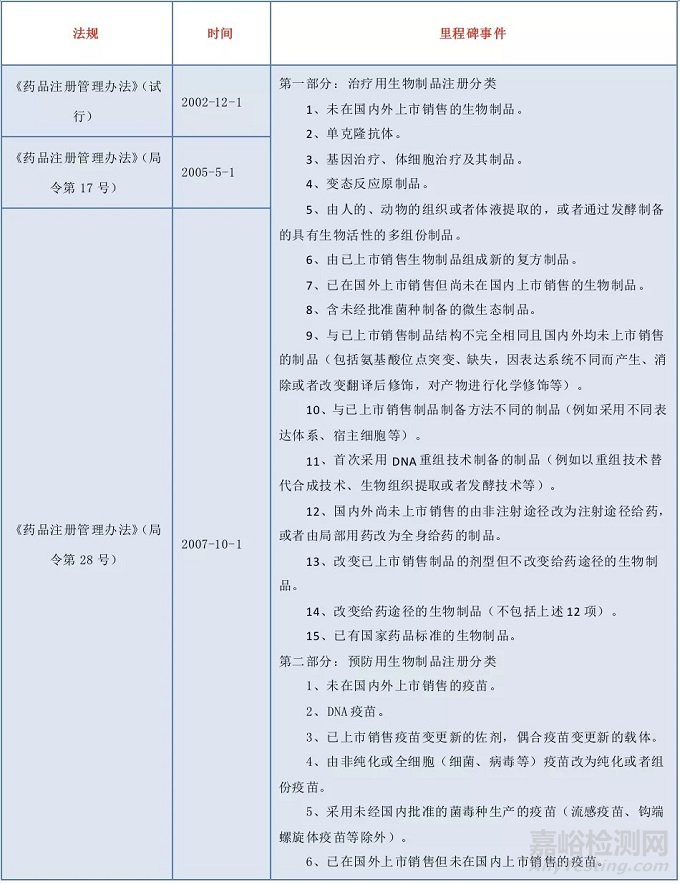
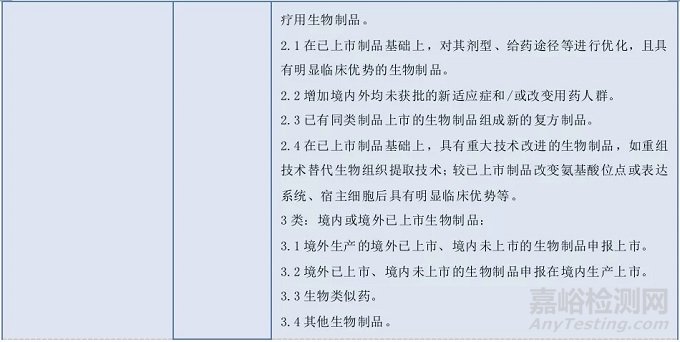
我國生物制品注冊分類有哪些變化?
生物制品是藥品的一大類別,我國對生物制品的質量管理及技術規范,歷來都很重視。
1985年衛生部頒布了第一部《新生物制品審批辦法》,首次將新生物制品劃分為四類注冊分類,生物制品注冊分類三十多年來經歷了從無到有、從欠缺到不斷完善的發展歷程。

[1] www.cfdi.org.cn
[2] 馮美卿主編,生物技術制藥
[3] www.chp.org.cn

來源:蒲公英


