您當前的位置:檢測資訊 > 生產品管
嘉峪檢測網 2024-09-19 08:16
與批次和補料分批培養不同,連續細胞培養通過補充新鮮培養基,同時去除耗竭培養基,維持生物反應器內恒定的體積,通常可達到極高的細胞密度,這就意味著培養基灌流速率高于細胞生產速率,細胞需被截留在生物反應器內。目前市面上有不同類型的細胞截留裝置。但是,最常使用的是切向流過濾(TFF)或交替式切向流(ATF)。
早在80年代后期和90年代初,連續培養已被考慮用于生物制藥,彼時,連續生產主要用于生產不穩定的蛋白質。但隨著對生物藥需求的增加以及市場競爭的加劇,行業開始尋求更高效、更靈活的工藝和設施。為解決這種新的挑戰,制藥行業開始重新審視連續培養作為一種解決方案的可能性。
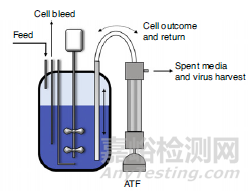
使用配置交替式切向流(ATF)過濾的攪拌罐生物反應器進行灌流培養,以進行病毒顆粒連續生產時的反應器配置(S.Gutierrez-Granados, et al. 2018)。
盡管連續培養的操作更加復雜,但與批次和補料分批相比,其優勢也非常明顯。連續補加培養基可獲得更高的細胞密度。與此同時,可能會影響細胞生長或蛋白質生產的代謝副產物被連續去除。這通常可轉化成更高的單位體積產量,相應地降低生物反應器尺寸、降低生產線占地以及成本投入,而生產批次的大小由操作時間決定,而不是生物反應器的大小。產物可連續收獲,這對于不穩定的蛋白質來說是一項明顯的優勢,因如其在生物反應器滯留時間過長,可能因為培養的條件,而損失其質量屬性。總體來說,相比其它培養模式,連續培養可強化工藝,增強操作的靈活性,而降低成本。
過去一段時間,連續培養在蛋白質和單克隆抗體生產上的應用已經得到了很大的發展,而參考原文關注了使用連續培養進行病毒(疫苗和病毒載體)的生產,以及這種培養模式怎樣操作和優化,以提高基于細胞培養的病毒性產物的產量和質量。
1、病毒性疫苗的連續生產
基于細胞培養的病毒性疫苗包括相對“經典”的減毒和滅活病毒以及新一代的非感染性病毒樣顆粒(VLP)。這種多樣性也反映在其生產方法:一些疫苗通過感染宿主細胞生產,而另一些使用穩定或瞬時異源性蛋白質表達方法生產。不管哪種方法,都需要克服相應的生產挑戰,包括提高滴度、獲得更加經濟的工藝,以及保證產物質量,后者會直接影響疫苗免疫源性和安全性。
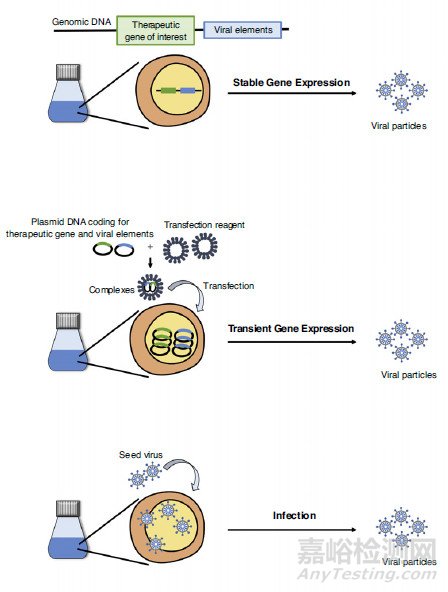
常見生產方式(瞬時轉染、病毒感染及穩定細胞系)示意圖(S.Gutierrez-Granados, et al. 2018)。
連續培養為基于細胞的病毒性疫苗生產工藝的優化提供了解決方案。已有關于不同連續培養方法的報導。
2、用于疫苗生產的灌流培養
與重組蛋白和單克隆抗體不同的是,病毒結構的復雜性妨礙了宿主細胞生產大量病毒的能力,所以,細胞特異性病毒產率通常較低。出于此原因,為細胞連續提供新鮮的營養物質,同時去除代謝副產物,有助于提高細胞所能生產的病毒數量。Nikolay等在批次搖瓶中以BHK-21懸浮細胞生產寨卡病毒,比使用貼壁Vero細胞的標準生產,產率要低(9x10^3 PFU/mL vs. ~10^7PFU/mL)。為提高滴度,作者使用ATF系統進行了灌流培養。感染前,通過將灌流速率從0.15VVD提升至0.42VVD,細胞生長至12x10^6cells/mL。感染后,灌流維持6天,達到3.9x10^7PFU/mL的生產結果。盡管相比貼壁細胞培養,懸浮細胞的特異性病毒產率仍較低,但是建立了一種用于寨卡病毒的產量足夠的可放大生產工藝。
Cervera等開發了一種可強化人免疫缺陷病毒(HIV)VLP生產的新方法,使用重復瞬時轉染和培養基置換的HEK293細胞培養,命名為Extended Gene Expression(EGE)。轉染后,每48小時置換培養基,相比72小時的批次培養,蛋白質生產可提高8倍。而結合兩次再轉染,可提高12倍。在配有灌流的1.3L生物反應器上成功操作了這種方法,以0.5VVD的速率置換培養基,使用連續灌流,細胞可生長至更高的細胞密度(~16x10^6cells/mL),高于使用不連續培養基置換的搖瓶培養,同時維持VLP滴度。所以,EGE是一種可強化瞬時轉染工藝的非常有潛力的策略,可進一步優化以獲得更高的VLP滴度。
Fontana等使用穩定的HEK293細胞系生產了狂犬病毒樣顆粒。作者使用5L生物反應器,以灌流模式,培養細胞20天,使用旋轉濾器截留細胞。使用這種方法,培養密度可達到16x10^6cells/mL,相比批次模式,細胞密度翻倍。由于基于VLP的疫苗可穩定生產,生物反應器內細胞越多,即直接意味著可生產更多的產物。這可降低生產工藝的成本,進而顯著影響動物疫苗的生產。
3、通過灌流克服細胞密度效應
細胞密度效應是一種廣泛報導的現象,即細胞在高密度(0.5-5x10^6cells/mL以上,取決于每種特定的細胞系)條件下感染或轉染時,細胞特異性產率會顯著降低。造成這種現象的主要假設是在高密度條件下,營養物質被“剝奪”,在此類條件下,細胞很難生產高病毒滴度。灌流已被證實有助于客服“細胞密度效應”的限制:以灌流模式培養的細胞在更高的細胞密度條件下被感染或轉染,可維持細胞特異性產率。
Genzel等通過感染AGE和CAP細胞生產流感病毒,以ATF系統進行灌流。AGE細胞在50x10^6cells/mL條件下感染,CAP細胞在25x10^6cells/mL條件下感染,相比低細胞密度感染,兩種情況均可維持特異性病毒產率,明顯克服了細胞密度效應。Petiot等報導感染使用聲學過濾器灌流培養的HEK293細胞,生產流感病毒。HEK293細胞在灌流中呈現中更加活躍的代謝狀態,從而使滴度增加10倍。Venereo-Sanchez等使用生產血凝素(HA)和神經氨酸酶(NA)的可誘導細胞系生產基于VLP的流感疫苗,瞬時轉染Gag-GFP作為VLP的核蛋白。通過灌流培養HEK293細胞,以在誘導HA和NA表達及Gag轉染前,達到高細胞密度(14x10^6cells/mL)。由于特異性病毒產量不受影響,相比批次培養,灌流培養的Gag-GFP和HA滴度分別增加了60倍和17倍。
4、病毒性疫苗的連續收獲
基于病毒的疫苗滴度也會受到收獲時間的影響。病毒通常對生物反應器內的理化狀態較為敏感,如果滯留時間過長,可能會影響其感染性。出于這個原因,如果病毒可被連續收獲,即可被立即處理或儲存于適合的條件下,以維持其特性。Petiot等對不同溫度條件下的流感病毒的穩定性進行了研究,觀察到,如果生產在35℃條件下進行,且病毒連續收獲,并儲存于2-8℃,滅活率會顯著低于在37℃條件下進行的更長時間的培養。此外,細胞培養基的連續去除可避免細胞副產物(宿主細胞DNA和蛋白質)的累積,有利于病毒特性的保持,也可簡化下游工藝。
5、用于疫苗生產的其它類型的連續培養
兩階段連續生物反應器是以連續模式生產病毒的另一種替代方法。該系統由物理性分離的兩個串聯生物反應器組成,一個用于細胞生長,一個用于病毒生產階段。詳細介紹,請參考原文。
6、病毒載體的連續生產
盡管過去幾年對病毒載體的興趣在不斷增加,但對生產工藝的關注卻不多。需要開發高效、可放大、穩健且可重復的生產工藝,以滿足基因治療行業對病毒載體不斷增加的需求,同時保證合理的成本。最常使用的系統仍然是批次或補料分批,且多數基于貼壁細胞。但是,為克服這些策略的限制,灌流受到了越來越多的關注。病毒載體可通過感染、瞬時轉染或生產細胞系生產。使用灌流培養模式的不同系統已有文獻報導。詳細介紹,請參考原文。
7、使用懸浮細胞的病毒載體灌流生產
慢病毒載體
慢病毒的半衰期為4-16小時,所以對于其生產來說,批次或補料分批不是非常有吸引力的選擇。“假”灌流可用于慢病毒的小規模生產,將轉染時的細胞密度從1x10^6cells/mL提升到5x10^6cells/mL,同時維持2TU/cell的恒定產率。轉染前后,以1RV/day的置換量,離心置換培養基。該方法轉移至生物反應器規模時,轉染后進行灌流,可收獲慢病毒,去除殘留的轉染復合物,并為轉染的細胞提供額外的營養物質。
最近,Manceur等使用可誘導HEK293生產細胞系,生產慢病毒載體。實驗測試了兩個不同的灌流策略。在第一種策略中,在整個生物工藝過程中(誘導前/后)使用基礎商業培養基進行灌流。在第二種策略中,使用強化的培養基達到目標高細胞密度,并在誘導后開始灌流模式。使用灌流策略,病毒滴度達到8x10^10TU/L,是批次模式的15倍。
逆轉錄病毒載體
灌流也被用于逆轉錄病毒的生產,使用懸浮馴化的293GPG包裝細胞。使用3L生物反應器灌流培養,結果顯示,相比批次模式,莫洛尼小鼠白血病病毒(MoMLV)病毒顆粒滴度增加2倍(2.3x10^7IVP/mL)。Grieger等測試了從懸浮培養基中連續收獲rAAV的方法,相比批次對照組,AAV8和AAV9分別增加了6.5倍和4.8倍。
腺病毒載體
腺病毒載體生產時,如以批次模式進行,在高細胞濃度條件下,會觀察到細胞密度效應。已經研究過不同的方法,以規避這個問題,例如在轉染前后置換培養基以及通過補料分批優化批次結果。但灌流是克服腺病毒生產中細胞密度效應的最可行的策略。在用于重組腺病毒的293S細胞培養中,為提高細胞密度,使用TFF設備,以灌流模式進行了腺病毒的生產。在1VVD的灌流速率條件下,10天內,293S細胞生長至14x10^6cells/mL。用于腺病毒生產時,三個293細胞培養以1VVD的灌流速率,平行進行,在平均密度8x10^6cells/mL時感染,即相當于對數生長中期。一個培養設置為37℃,另兩個設置為35℃。結果是,在37℃條件下,可生產3.2x10^9感染性病毒顆粒(IVP)/mL,在35℃條件下為7.8x10^9IVP/mL,至少是批次對照組的5.5倍。
ATF灌流設備也被測試用于溶瘤性腺病毒載體(ONYX-411)的生產,使用HeLaS3細胞系。生物反應器以批次模式開始,當乳酸濃度超過1.3g/L時,開始灌流。補液策略基于維持葡萄糖濃度高于2g/L,且乳酸濃度低于2g/L。每天兩次檢查灌流速率,以滿足細胞培養要求。培養感染后,停止灌流3小時,以避免“洗掉”用于感染的病毒。結果顯示,補料分批和灌流培養的平均細胞特異性病毒產率相當,分別為3.1x10^4VP/cell和3.3x10^4VP/cell。但是收獲時,灌流培養中檢測到的平均病毒滴度約為補料分批培養的4倍,因為在感染時,活細胞密度差為4倍。
8、總結和展望
隨著新一代基因治療臨床試驗數量的增加,以及新的、基于細胞的疫苗的不斷發展,在未來的一段時間內,病毒顆粒生產技術還將繼續其革新,以作為向患者有效、安全地提供新型治療方法的關鍵部分。為滿足這方面的預期,必需面對一些挑戰。首先,需要降低生產的成本,以使工藝更具經濟性,更有行業競爭力,以獲得患者“負擔得起”的治療方式。其次,需要建立更加靈活的生產設施,以滿足更加多樣化的管線的要求。一方面,建立針對可能的、新病毒的爆發的快速反應,生產所需的疫苗,是必然的要求。而另一方面,藥物也在向更加個體化的方向發展,待治療的患者群體更小,治療更加“精準”。這也就意味著未來的生產設施需具有生產多個藥物的能力,而每個的生產量則可能會降低。新技術的發展需能相應這些挑戰。
生物制藥行業的生產模式的轉變正在發生,批次和補料分批模式正逐漸被連續生產取代。使用連續技術獲得的病毒顆粒生產的成功案例、新的監測和控制技術的發展以及連續下游工藝的整合,將極大的促進連續平臺的鞏固,以用于作為治療性藥物的病毒的生產和純化。
參考原文:S.Gutierrez-Granados, F.Godia, L.Cervera, Continuous manufacturing of viral particles. Current Opinion In Chemical Engineering. 2018, 22: 107-114.

來源:求實藥社


