您當前的位置:檢測資訊 > 實驗管理
嘉峪檢測網 2024-11-02 08:53
各位小伙伴大家好,瓊脂糖凝膠電泳作為分子生物學實驗中最為基礎而常用的技術,從而在實驗室中廣泛應用,所以學會瓊脂糖凝膠電泳是進入分子生物學實驗室的必要技巧之一。
接下來我將著點于,實驗原理、實驗步驟、注意事項以及疑難解答等幾個方面向各位小伙伴們詳細闡述。
實驗原理
電泳即利用化合物的分子量或帶電荷量在穩定電場中所受阻力或者電場力的不同,從而遷移效率不同,來達到分離化合物的目的。而瓊脂糖凝膠電泳,簡單來說就是以瓊脂糖凝膠作為電泳介質來承載化合物進行電泳。瓊脂糖是D-和L-半乳糖殘基通過α(1→3)和β(1→4)糖苷鍵交替構成的線狀聚合物。瓊脂糖鏈形成螺旋纖維,后者再聚合成半徑20~30nm的超螺旋結構。瓊脂糖凝膠可以構成一個直徑從50nm到略大于200nm的三維篩孔的通道,從而給予化合物分子可以通過的空間以及一定的阻力。
影響DNA的遷移效率的因素
1、通過凝膠的電流與電壓
根據歐姆定律,V= IR因為用于電泳的緩沖液通常是微堿性的(pH 7.8~8.0),通過凝膠的DNA分子攜帶負電荷,并以所施加的電流形成的速率向陽極遷移。
低電壓時,線狀DNA片段遷移率與所用的電壓成正比。但是,電場強度升高時,高分子質量DNA片段的遷移率不成比例增加。所以,當電壓增大時,瓊脂糖凝膠分離的有效范圍反而減小。要獲得大于2kb DNA片段的良好分辨率,則所用電壓不應高于5~8V/cm。
2、DNA分子的大小
雙鏈DNA分子在凝膠基質遷移的速率與其堿基對數的常用對數成反比。大分子DNA摩擦阻力大,通過凝膠孔徑的效率低于小分子DNA,因此遷移速率慢。
3、瓊脂糖濃度
瓊脂糖凝膠是由氫鍵和疏水作用聚合在一起的多孔膠體。在電流的作用下,DNA線性分子通過一系列孔徑泳動,這些孔徑的有效直徑取決于凝膠中瓊脂糖的濃度。在DNA電泳遷移率的對數和凝膠濃度之間存在線性關系。
4、DNA的構象
超螺旋環狀(I型)、切口環狀(II型)和線性(I型) DNA在瓊脂糖凝膠中遷移速率不同。絕大多數情況下,區分不同構象DNA的最佳方式是在電泳系統中加入未處理的環狀DNA樣品和在單一限制酶切位點經酶切消化后的同一線狀DNA樣品。
5、凝膠和電泳緩沖液中的染料
染料插入雙鏈DNA造成其負電荷減少,而剛性和長度增加。因此,線狀DNA-染料復合物在凝膠中的遷移率約降低15%。
6、瓊脂糖種類
常見的瓊脂糖主要有兩種:標準瓊脂糖和低熔點瓊脂糖。正在研制的第三種是熔點和凝點介于,上述二者之間的瓊脂糖,它兼有兩者的特性。每一大類中都有不同種類的瓊脂糖用于不同的分離目的。
7、電泳緩沖液
DNA的泳動受電泳緩沖液的組成和離子強度的影響。缺乏離子(如用水替代電泳槽及凝膠中的緩沖液)則電導率降至很低,DNA遷移極慢,或者完全不動。高離子強度時,如錯用了10X電泳緩沖液,電導率升高,即使應用適中的電壓也會產生大量的熱量。最嚴重時凝膠會熔化,DNA會變性。
實驗步驟
1、選擇合適的塑料托盤,置于潔凈的制膠模具中,并置于水平實驗臺上。
2、配制足量的電泳緩沖液(1×TAE或0.5×TBE)用以灌滿電泳槽和配制凝膠。
▲配膠和灌滿電泳槽使用同一批緩沖液很重要。因為即使很小的離子強度或pH差別也會導致凝膠性能異常,嚴重影響DNA片段的泳動。當檢測未知DNA片段的大小時,一定要保證所有樣品在同一緩沖液配置的同樣凝膠中分析。
3、根據欲分離DNA片段大小,用電泳緩沖液配制適宜濃度瓊脂糖溶液:應準確稱量瓊脂糖干粉加到盛有定好量的電泳緩沖液的三角燒瓶或玻璃瓶中。
▲緩沖液體積應小于燒瓶或玻璃瓶容積的50%。
▲分離不同大小的DNA所需的瓊脂糖凝膠濃度如表。一些高分辨率瓊脂糖凝膠能分離只有幾個堿基對差別的DNA。此外,經修飾的多糖加到瓊脂糖中可以增加分辨率。修飾多糖與瓊脂糖混合制成的濃度為0.5%~2.0% (m/V)的凝膠不僅分辨率增加,而且更清亮,強度更好。
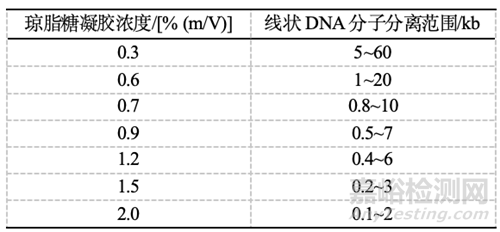
表1 不同含量標準低電內滲瓊脂糖凝膠的分離范圍
▲警惕:微波爐加熱時間過長,瓊脂糖溶液會變得過熱或劇烈沸騰。
▲僅加熱所有瓊脂糖顆粒完全溶解需要的最短時間。通常未熔解的瓊脂糖呈小透明體或半透明碎片懸浮在溶液中。戴上手套,不時地小心旋轉三角燒瓶或玻璃瓶,以保證黏在壁上的未熔化的瓊脂糖顆粒進入溶液。
▲熔解較高濃度的瓊脂糖需要較長的加熱時間。
▲要查看煮沸后是否由于蒸發而溶液體積減少,如有必要用水恢復原體積。
4、待熔化的凝膠稍冷卻后加入熒光染料(如:溴化乙錠,終濃度為0.5μg/mL;或按照使用說明加入其他染料)。輕輕地旋轉以充分混勻凝膠溶液。
▲警惕: SYBR Gold不應加到熔化的凝膠溶液中。
▲熒光染料也可以直接混入樣品,或者待電泳結束后浸泡染色。
5、瓊脂糖溶液正在冷卻時,選擇一個合適的梳子用來制造加樣孔。梳齒底部的位置應在托盤底面,上0.5~1.0mm,這樣瓊脂糖澆灌到托盤時將形成符合要求的加樣孔。
▲多數凝膠托盤都有適宜放梳子的側壁或外側支架。如果沒有或不合適,梳齒可能會太接近托盤底面,在拔出梳子時易穿透加樣孔的底部,樣品液將從凝膠和加樣孔之間泄露。
6、澆灌溫熱的瓊脂糖溶液進入模具。
▲凝膠適宜厚度為3~5mm。需檢查在梳齒下或梳齒間應無氣泡。熔化的凝膠液中的氣泡用擦拭紙的角輕觸或使用移液槍即可容易除去。
▲制備低濃度瓊脂糖凝膠(<0.5%)時,先倒一個1%濃度瓊脂糖的支持膠,它沒有加樣孔。讓支持膠在托盤或玻璃板上室溫下硬化,然后再直接在支持膠.上倒低濃度凝膠。此方式制備的凝膠明顯減少了在后續如照相或Southern雜交等操作過程中可能造成的低濃度膠斷裂。需要保證兩個濃度的凝膠用同一批緩沖液配制,且含有相同濃度的染料。低熔點和低于0.5%濃度的瓊脂糖凝膠也可以冷卻到4°C,并在冷室中電泳以減少斷裂的機會。
7、讓凝膠溶液完全凝結,室溫下需30~45min。加少量電泳緩沖液于凝膠頂部,小心拔出梳子。將凝膠安放到電泳槽內。
8、向電泳槽加入電泳緩沖液,剛好沒過凝膠約1mm。
▲沒有必要在加樣前對瓊脂糖凝膠進行預電泳。
9、將DNA樣品和對應體積的上樣緩沖液混合(常用的DNA上樣緩沖液有10×、6×等)。
▲加樣孔能加入DNA的最大量取決于樣品中DNA片段的大小和數目。若一個5mm寬條帶含有500ng以上的DNA時,說明加樣孔過載,會導致拖尾、條帶兩側卷翹的“微笑效應”和模糊不清等現象。如果DNA長度增加,上述現象變得更為嚴重。分析單一DNA樣品(如λ噬菌體或質粒DNA)時,每個5mm寬加樣孔可加100~ 500ng,DNA。如果樣品由不同大小的許多DNA片段組成(如哺乳類動物DNA的酶切樣品),則每個加樣孔加入20~30μg的DNA也不會造成分辨率明顯下降。
▲加樣DNA的最大體積是由加樣孔容積決定的。通用的加樣孔(0.5cm×0.5cm×0.15cm)可容納約40μL樣品。切忌將加樣孔加得太滿,甚至溢出。為避免溢出造成鄰孔樣品污染,最好配置稍厚些的凝膠能夠增加加樣孔容積或通過乙醇沉淀濃縮DNA減少加樣體積。
10、用一次性吸頭、自動移液器、拉長的巴斯德吸管或玻璃毛細管將樣品混合液緩慢加至浸沒凝膠的加樣孔內。DNA分子質量標準品應分別加至樣品孔的左側和右側的兩個孔內。
11、關上電泳槽蓋,接好電極插頭。DNA應向陽極(紅色插頭)側泳動。給予1~8V/cm的電壓,其中距離以陽極至陰極之間的測量為準。如電極插頭連接正確,陽極和陰極由于電解作用將產生氣泡,并且幾分鐘內溴酚藍從加樣孔遷移進入膠體內。待溴酚藍和二甲苯藍FF遷移到適當距離后停止電泳。
▲溴化乙錠的存在使凝膠在電泳的任何階段都能夠置于紫外燈下觀察。此時,可以除去托盤,直接放凝膠于透光板上。也可以用一個手提式紫外光源檢查凝膠。不管哪種方式,應在檢查時短時間關閉電源。
▲電泳期間,溴化乙錠向陰極遷移(與DNA遷移方向相反)。長時間電泳將導致凝膠中溴化乙錠含量顯著減少,使小片段DNA檢測發生困難。此時,可將凝膠浸入0.5μg/mL溴化乙錠溶液染色30~45min。
12、當DNA樣品或染料在凝膠中遷移了足夠距離時,關上電源、拔出電極插頭并打開電泳槽蓋。若凝膠和電泳緩沖液中含有溴化乙錠,用紫外燈觀察凝膠和用裝有紫外線透射濾光片的CCD相機照相。
13、凝膠電泳結束后可進行切膠回收DNA,也可以進一步進行Southern印跡分析。
疑難解答
1. 使用水代替凝膠緩沖液或電泳緩沖液
瓊脂糖凝膠配制和電泳通常使用TAE或TBE緩沖液進行。如果您使用水進行凝膠配制和跑電泳,您的凝膠將在電泳時很快融化。TAE、TBE和水都是透明的溶液;因此,在配制時請檢查容器的標簽。
2. 使用了錯誤濃度的瓊脂糖
DNA凝膠電泳所需的標準瓊脂糖濃度為1.0%。濃度越高,小條帶的分辨率越高;反之,瓊脂糖濃度越低,大分子量條帶的分辨率和分離程度越高。如果使用了錯誤濃度的瓊脂糖凝膠,就很難確定DNA條帶的可靠性。當使用低百分比濃度瓊脂糖凝膠時要小心;它們往往較軟,更容易破損。
3. 顛倒了電泳槽與電源連接線的方向
這是很容易犯的錯誤,但是如果你不小心顛倒了電泳槽與電源連接線的方向,結果將會非常令人沮喪。因為樣本會向相反方向移動,而且由于上樣孔與凝膠的末端很近,您會丟失所有的樣本。開始您的電泳后確保DNA樣本以正確的方向進入凝膠;如果您看到您的條帶向錯誤的方向移動,請顛倒電源線的方向。
4. 什么是適合于您的瓊脂糖凝膠電泳的正確緩沖液?
進行DNA瓊脂糖凝膠電泳所需的緩沖液類型,主要取決于DNA片段大小和電泳后的應用。進行瓊脂糖凝膠電泳最常見的兩種緩沖液是Tris-乙酸EDTA緩沖液(TAE)和Tris-硼酸EDTA緩沖液(TBE)。因為兩種緩沖液的pH值都接近中性,所以緩沖液中的DNA都帶凈負電荷并向凝膠裝置正極(+)方向移動。
對于小片段DNA (<1000 bp),如果沒有計劃從凝膠中回收DNA,那么推薦使用1×TBE緩沖液。TBE溶液具有高離子強度和緩沖能力。TAE緩沖液,結合低電場強度(1–2 V/cm),最適于分離大DNA(12–15 kb)。TAE緩沖液與瓊脂糖相互作用,相比較TBE緩沖液中的瓊脂糖凝膠,會產生更低的電滲透,更大的表面孔經,和更低的電場強度,可降低大DNA的smear現象。
5. 為了獲得最好的分辨率您需要的DNA上樣量是多少?
DNA樣本量可以是各種各樣的,關鍵是您正在分離的DNA條帶的DNA含量。最小可能被檢測的DNA的量依賴于所使用的染色方法(例如,使用SYBR Safe DNA凝膠染色可以檢測出 3 ng的DNA。一個清晰且界限分明的條帶中DNA最大量為100 ng。
6. 凝膠配制如何影響條帶分辨率?
推薦的瓊脂糖凝膠厚度為3-4 mm;厚度超過5mm的凝膠會產生模糊的條帶和更高的染色背景。與此類似,覆蓋在電泳裝置中凝膠上的電泳緩沖液厚度為3-5mm。緩沖液太多會降低DNA遷移率并造成條帶變形。
梳齒的厚度也很重要,它會顯著影響分辨率。薄梳(1 mm)會給出界限清晰的條帶,而厚梳會產生厚條帶,導致分辨率降低。梳齒應充分清洗以去掉可能的殘留物,否則可能會在泳道內產生波浪線。此外,在去除梳齒前要先加入緩沖液,以減少瓊脂糖孔附近的撕裂。
7. 凝膠類型影響條帶分辨率嗎?
根據DNA的應用和大小,瓊脂糖類型會影響DNA分辨率。凝膠強度,凝膠融解溫度,和電滲透是選擇合適瓊脂糖時的重要因素。
8. 您如何選擇瓊脂糖凝膠電泳運行環境?
推薦的凝膠電泳裝置內的電壓是4–10 V/cm(正極和負極之間的距離,不是凝膠長度)。如果電壓太低,遷移率會降低,而且條帶會因擴散而變寬。如果電壓太高,條帶分辨率會降低,這主要是由于凝膠過熱引起的。
9. 若DNA條帶呈微笑狀、波浪形怎么處理?
一般考慮膠質不均導致的,可以適當提高灌膠溫度,選用小分子核酸染料,不在跑膠時進行染色、換在電泳結束后進行泡染(將凝膠浸入0.5μg/mL溴化乙錠溶液染色30~45min)。

來源:實驗老司機


