您當(dāng)前的位置:檢測(cè)資訊 > 科研開發(fā)
嘉峪檢測(cè)網(wǎng) 2024-12-12 18:43
一、基本概況
1、自然環(huán)境
日本位于太平洋西岸,是一個(gè)由東北向西南延伸的弧形島國(guó)。西隔東海、黃海、朝鮮海峽、日本海與中國(guó)、朝鮮、韓國(guó)、俄羅斯相望。陸地面積約37.8萬平方公里,包括北海道、本州、四國(guó)、九州四個(gè)大島和其它6800多個(gè)小島嶼。屬溫帶海洋性季風(fēng)氣候,終年溫和濕潤(rùn)。
2、人口和行政區(qū)劃
日本人口約1億2339萬(2024年1月)。主要民族為大和族,北海道地區(qū)約有1.3萬阿伊努族人。通用日語。主要宗教為神道教和佛教。日本65歲以上老齡人口數(shù)約占人口總數(shù)的三成,是世界上人口密度最大和老齡化最嚴(yán)重的國(guó)家之一。
日本全國(guó)劃分為1都(東京都:Tokyo)、1道(北海道:Hokkaido)、2府(大阪府:Osaka、京都府:Kyoto)和43縣(省),下設(shè)市、町、村。首都東京是日本的政治、經(jīng)濟(jì)、文化中心,人口約1411萬(2024年1月)。
3、2024年出口概況
日本是世界經(jīng)濟(jì)強(qiáng)國(guó)。據(jù)統(tǒng)計(jì),2023年日本實(shí)際國(guó)內(nèi)生產(chǎn)總值(GDP)約559萬億日元,同比增長(zhǎng)1.9%。2024年1-6月,中國(guó)向日本出口醫(yī)療器械總計(jì)約111.74億元人民幣,同比下降5.34%。
二、日本醫(yī)療器械監(jiān)管機(jī)構(gòu)和法規(guī)要求
日本醫(yī)療器械的監(jiān)管機(jī)構(gòu)為厚生勞動(dòng)省(Ministry of Health, Labor and Welfare, MHLW),其與醫(yī)療器械監(jiān)管有關(guān)的主要職責(zé)有:①制定醫(yī)療器械監(jiān)管政策,②注冊(cè)批準(zhǔn)的最終審查,③產(chǎn)品退市。
日本獨(dú)立行政法人醫(yī)藥品與醫(yī)療器械綜合機(jī)構(gòu)局(Pharmaceuticals and Medical Devices Agency, PMDA)是一個(gè)獨(dú)立的行政機(jī)構(gòu),其與厚生勞動(dòng)省合作,以確保醫(yī)療器械的安全和質(zhì)量;PMDA協(xié)助MHLW醫(yī)療器械監(jiān)管政策實(shí)施的職責(zé)包括:1)醫(yī)療器械審批審核,2)QMS/GLP/GCP檢查,3)不良事件報(bào)告的收集和分析。
日本醫(yī)療器械注冊(cè)需要遵循《藥品與醫(yī)療器械法》(Pharmaceutical and Medical Device Act,縮寫為PMD Act)。
三、醫(yī)療器械定義
根據(jù)PMD Act第2條第4項(xiàng),醫(yī)療器械定義為:用于診斷、治療或預(yù)防人類或動(dòng)物疾病或影響人類或動(dòng)物身體結(jié)構(gòu)或功能的試劑、耗材和設(shè)備。
“この法律で「醫(yī)療機(jī)器」とは、人若しくは動(dòng)物の疾病の診斷、治療若しくは予防に使用されること、又は人若しくは動(dòng)物の身體の構(gòu)造若しくは機(jī)能に影響を及ぼすことが目的とされている機(jī)械器具等(再生醫(yī)療等製品を除く。)であつて、政令で定めるものをいう。”
根據(jù)PMD Act第2條第14項(xiàng),體外診斷試劑定義為:專門用于疾病診斷的藥物,且該藥物不直接用于人體或動(dòng)物體內(nèi)。
“この法律で「體外診斷用醫(yī)薬品」とは、専ら疾病の診斷に使用されることが目的とされている醫(yī)薬品のうち、人又は動(dòng)物の身體に直接使用されることのないものをいう。”
四、產(chǎn)品分類與符合性路徑
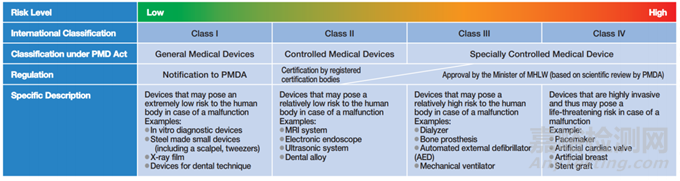
醫(yī)療器械根據(jù)其對(duì)人類造成的危險(xiǎn)程度進(jìn)行分類,分為一般醫(yī)療器械(Class I)、管理醫(yī)療器械(Class II)和高度管理醫(yī)療器械(Class III, IV)。醫(yī)療器械分類不同,其符合性路徑不同;即Class I僅需向PMDA備案(屆出),大部分Class II及小部分Class III(有產(chǎn)品標(biāo)準(zhǔn))需提交J-RCB(日本第三方公告機(jī)構(gòu))認(rèn)證,而小部分Class II、大部分Class III及所有Class IV需經(jīng)PMDA審核后MHLW承認(rèn)。

五、注冊(cè)流程
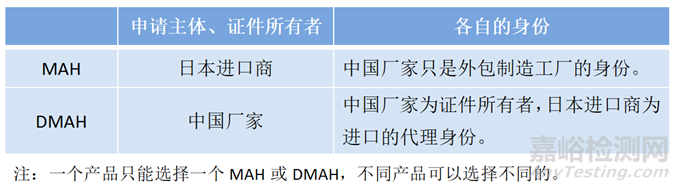
1、注冊(cè)主體
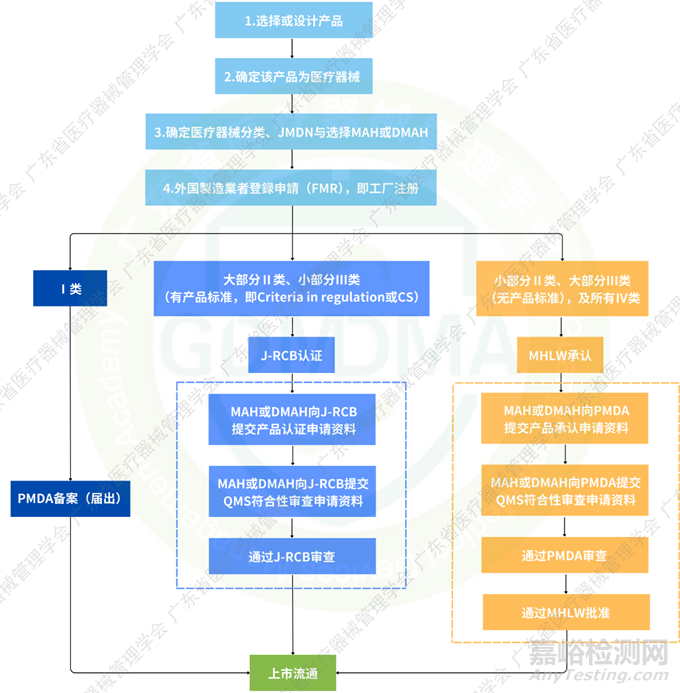
2、注冊(cè)流程
備注:
1)符合資質(zhì)的J-RCB名單可檢索登録認(rèn)証機(jī)関;
2)產(chǎn)品相關(guān)證書無有效期,工廠注冊(cè)證書及QMS證書有效期均為5年;
3)QMS符合性審查申請(qǐng)可于產(chǎn)品注冊(cè)申請(qǐng)受理后10個(gè)工作日內(nèi)提交。
3、注冊(cè)資料
1)工廠注冊(cè):企業(yè)名稱及地址,企業(yè)法定代表人簡(jiǎn)歷(如提供原文及日文翻譯件,且如原文不是英文,需同時(shí)提供翻譯者資質(zhì)證明),生產(chǎn)場(chǎng)地平面圖。
2)產(chǎn)品備案:提交“醫(yī)療機(jī)器製造販売屆書”,即備案申請(qǐng)表(日文)。
3)產(chǎn)品認(rèn)證需提交資料目錄清單視具體的J-RCB要求,符合資質(zhì)的J-RCB名單可檢索登録認(rèn)証機(jī)関。
4)認(rèn)證基準(zhǔn)
認(rèn)證基準(zhǔn)需要日本官網(wǎng)查詢, 類似國(guó)內(nèi)的指導(dǎo)原則, 需要確定產(chǎn)品需要滿足哪些 JIS 標(biāo)準(zhǔn)。PMDA有發(fā)布認(rèn)可協(xié)調(diào)標(biāo)準(zhǔn)清單,一般來講通用型的標(biāo)準(zhǔn)都認(rèn)為IEC和ISO的標(biāo)準(zhǔn),性能標(biāo)準(zhǔn)部分有發(fā)布不少JIS標(biāo)準(zhǔn),特別是沒有國(guó)際標(biāo)準(zhǔn)的產(chǎn)品。
5)產(chǎn)品承認(rèn)


備注:申請(qǐng)表及技術(shù)文件摘要(STED)須以日文提供,測(cè)試報(bào)告、臨床試驗(yàn)報(bào)告等附件資料可以英文提供。
6)QMS符合性審查 :以下為PMDA要求,至于J-RCB審核情況需視具體的J-RCB要求,符合資質(zhì)的J-RCB名單可檢索登録認(rèn)証機(jī)関。日本的質(zhì)量體系法規(guī)為MHLW Ministerial Ordinance No. 169, 2004及修訂案2021(對(duì)于外國(guó)制造商來說,基本上等同于ISO 13485的要求)。
◆ 申請(qǐng)?zhí)峤毁Y料清單
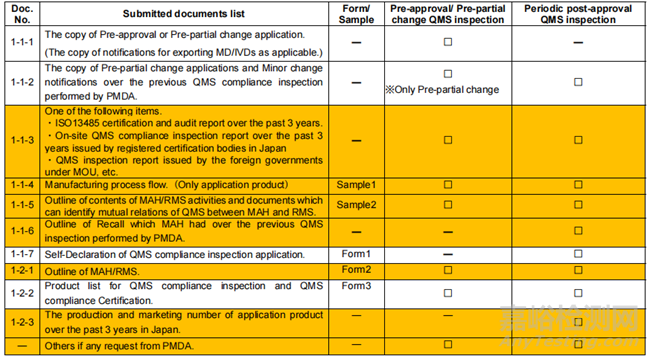
※Documents highlighted in orange is related to RMS.
※MAH: Marketing Authorization Holder. RMS:Registered Manufacturing Site.
◆ 線上審核資料清單
通常,審查機(jī)構(gòu)根據(jù)提交的QMS符合性審查申請(qǐng)資料決定采取線上還是現(xiàn)場(chǎng)審核方式。
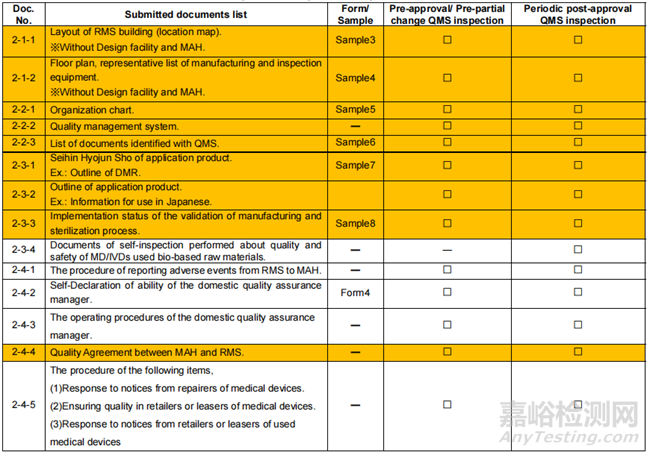
※ Documents highlighted in orange is related to RMS.
※ MAH: Marketing Authorization Holder. RMS:Registered Manufacturing Site.
※ MDSAP可豁免現(xiàn)場(chǎng)審核,及簡(jiǎn)化線上審核;相關(guān)信息可檢索MDSAP報(bào)告書の利用申請(qǐng)について。
◆ 現(xiàn)場(chǎng)審核安排
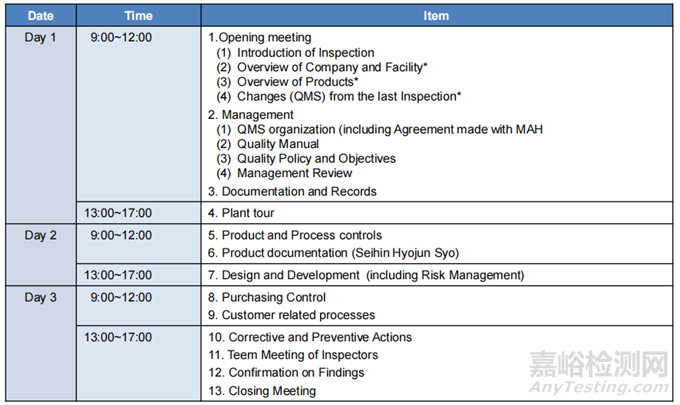
Note: As to items with*, Please give presentations to Inspectors.
4、注冊(cè)周期及費(fèi)用
工廠注冊(cè):1個(gè)月;90,000円
產(chǎn)品備案:即時(shí),免費(fèi)
產(chǎn)品認(rèn)證:視具體的J-RCB情況,符合資質(zhì)的J-RCB名單可檢索登録認(rèn)証機(jī)関
產(chǎn)品承認(rèn):4∼12個(gè)月,費(fèi)用可見手?jǐn)?shù)料
QMS符合性審查:約6個(gè)月,費(fèi)用可見QMS適合性調(diào)査手?jǐn)?shù)料計(jì)算
5、注冊(cè)提交
PMDA及MHLW注冊(cè)申請(qǐng)有關(guān)業(yè)務(wù)的提交方式可選擇FD申請(qǐng)或DWAP申請(qǐng),感興趣的同行可檢索:
FD申請(qǐng)、DWAP申請(qǐng)
備注:各類別醫(yī)療器械制造販賣許可證書的有效期如下表:

6、該區(qū)域有關(guān)UDI的要求
日本已于2022年12月全面強(qiáng)制實(shí)施UDI要求,包裝賦碼要求如下:

UDI申請(qǐng)及相關(guān)賦碼格式等要求詳情,可檢索GS1 Japan。
通常,格式選用GS1-128條形碼,對(duì)于體積較小且又需在本體上直接打碼的器械可選用GS1二維碼。

醫(yī)療器械獲得市場(chǎng)準(zhǔn)入后出貨前,MAH或DMAH需將UDI碼上傳“醫(yī)療機(jī)器データベース”,該數(shù)據(jù)庫面向企業(yè)的常規(guī)操作功能免費(fèi),賬號(hào)創(chuàng)建網(wǎng)址鏈接。
7、其他注意事項(xiàng)或特別提醒
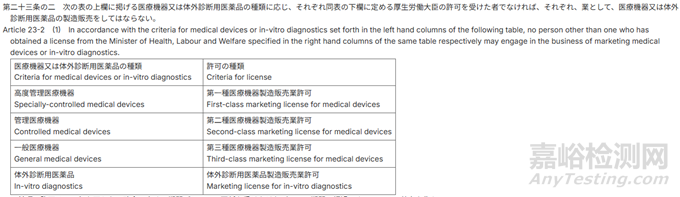
1)MAH資質(zhì)
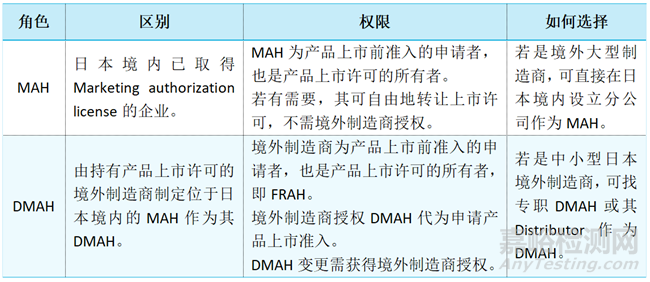
2)DMAH與MAH差異


來源:廣東醫(yī)療器械學(xué)會(huì)


