您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-01-23 08:34
Humacyte宣布計劃向FDA提交研究性新藥(IND)申請,以允許對小直徑(3.5mm)生物型人工血管(sdATEV)用于冠狀動脈旁路移植術(CAB)臨床研究。
目前Humacyte已經向FDA提交IND的計劃基于最近與FDA舉行的會議的結果,包括與FDA的協議。迄今為止,僅在人體試驗中研究了ATEV的6mm生物型人工血管,特別是在血管創傷修復、血液透析動靜脈(AV)通道和周圍動脈疾病(PAD)中進行的研究中。其用于治療肢體動脈損傷的血管的生物型人工血管---SYMVESS已經獲得FDA批準上市(這是FDA批準首款生物型人工血管)。
為了能夠順利獲FDA批準進行臨床研究,sdATEV已在多個臨床前CAB模型中進行了研究。
靈長類動物為期六個月的臨床前研究結果,三只狒狒的年齡在8至10歲,CABG血管將主動脈和右側冠狀動脈連接起來,術后六個月人造血管(sdATEV)依舊保持通暢。在術后6個月,對CABG血管進行組織學研究,CABG血管已經被患者自身細胞所填充,變成一條天然血管,人造血管變活了。
在臨床前CAB模型中,觀察到sdATEV維持了開放性(血流),與動物宿主細胞重新細胞化,并進行重塑,以有效減少sdATEV和動物天然動脈之間的初始尺寸不匹配。
高管評價
“我們很高興能夠更接近sdATEV在搭橋術中的人體臨床研究,我們計劃在FDA批準后提交IND和啟動首次人體研究將是Humacyte的一個重要里程碑。我們的臨床前結果表明,sdATEV可能是CAB中天然血管移植物的一種有希望的現成替代品,我們期待在人體臨床研究中評估這種可能性。”
---Laura Niklason Humacyte創始人兼首席執行官
冠脈搭橋在美國是非常常見手術,每年手術量高達50萬(國內只有5萬,國內心臟內科強勢啊)。在美國,高達90%的患者使用大隱靜脈進行搭橋,但是用大隱靜脈搭橋后一年手術失敗非常高(10%至25%的失敗率),十年失敗率則達到50%左右。另外采用大隱靜脈不僅手術時間長、創傷大,而且手術需要更多麻醉、更高的感染。同時不少患者大隱靜脈無法滿足冠脈搭橋需求。
人造血管有望解決人體自身血管不足,使得冠脈搭橋手術變得簡單、一致性,護理變得標準化,同時解決大隱靜脈失敗率高等問題。
目前海外有三家公司在快速推進用于冠脈搭橋的人工血管。其中遠大關聯公司Xeltis是推進最快,其在去年的EACTS會議上 全球首選項關于人工血管用于冠脈搭橋的臨床研究數據,顯示出優異的通暢率(術后十二個月),表明Xeltis的XABG具有長期耐用性的潛力,可能消除靜脈采集的需要并改變搭橋手術的格局。
Humacyte和Medical 21推進速度接近,都已經完成臨川前研究,就等FDA批準進行臨床研究。
可見未來5年左右,人工血管用于冠心病治療將取得巨大進展。
ATEV
ATEV是無細胞組織工程血管(acellular tissue engineered vessel)簡稱,其不僅保留血管生物力學特征,同時剔除可導致免疫排斥反應的成分。
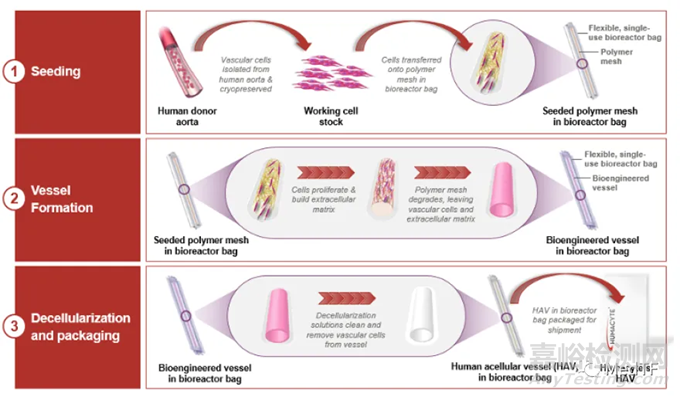
ATEV的制造過程可分為:
先從人類供體獲得血管細胞,然后對其進行組織培養,并且把細胞放在一個血管狀的可降解支架上。細胞組織浸浴在營養液中生長,并不斷延展從而獲得真正的血管所具有的物理特性。
數周后,細胞生長并產生新組織,形成管狀血管結構,而聚合物支架完全降解。
再將生物工程血管去細胞化以產生ATEV:一種細胞外基質,保留了血管的生物力學特征,但清除了可能誘導免疫反應的細胞成分。
Humacyte
Humacyte是由耶魯大學Laura E. Niklason院士于2004年創立的創新醫療器械公司,其正在開發一個顛覆性的生物技術平臺,以提供可普遍植入的生物工程人體組織和器官,旨在改善患者的生活并改變醫學實踐。

來源:MedTF


