您當前的位置:檢測資訊 > 生產品管
嘉峪檢測網 2024-09-05 08:15
為先進治療藥品(ATMP)建立穩健的污染控制策略(CCS)對于確保藥品的安全供應至關重要。由于大多數ATMP是非終端滅菌制劑,因此在生產過程的許多步驟中都需要進行無菌處理。這些過程與用于傳統生物制藥的生產過程相比,提出了獨特的挑戰。
本文提出了一種正式的、系統的方法,用于管理ATMP無菌加工的獨特風險,即無菌風險評估模型(Aseptic RiskEvaluation Model)。
什么是無菌風險評估模型(AREM)?
ATMP生產工藝的新穎性和復雜性在評估與工藝和污染控制相關的風險時帶來了明顯的挑戰。因此,當工藝開發的可用知識有限時(尤其是在cGMP控制環境中生產經驗有限時),風險評估過程的風險識別、分析和評估步驟可能會遇阻。在評估ATMP的無菌過程中,目前常用的方法工具大多都存在主觀性。從風險評估小組那里常聽到“我認為這應該是分值”(表明嘗試對未來的控制而不是當前狀態進行評分)或“我們還沒有這樣做,但應該沒問題”(表明在缺乏數據的情況下存在很大的偏差,并且某些組織的風險承受能力高于正常水平),這些確實表明需要一種新方法來處理這些評估事宜。
ICH Q9將風險定義為損害發生的可能性和損害的嚴重程度的組合。在某些情況下,風險評估方法需要評估可能性和嚴重性以外的參數,以便更好地了解危害的風險。無菌操作的“危害性”被定義為產品受到微生物污染,在識別風險時,該潛在危害的嚴重性始終被認為是“高”的。出于此,AREM工具旨在關注于無菌操作性能的參數,以及它們如何導致該生產過程受到微生物污染。在確定無菌操作的固有風險外,還有一些因素更適合幫助我們理解風險——操作時限Duration、復雜性Complexity和鄰近度Proximity。
無菌風險評估模型過程
與任何質量風險評估一樣,該過程從生命周期的風險啟動階段開始,通過定義風險問題,在這種情況下,可以簡單地理解為:“在藥品生產過程中,在無菌邊界內進行的每次單獨操作(無菌保證)失去無菌(無菌保證)的相對風險是多少?”
一旦您的風險問題得到提煉和透徹理解,就可以選擇最適合回答該問題的風險工具和方法。像上面這樣的風險問題非常適合AREM方法,完成這種基于風險的方法的簡單過程可以分解為以下步驟:
第1步:基于風險的方法的前期工作
風險評估,或者在這種情況下是基于風險的方法,只有用于告知風險的信息才能發揮作用。確保適當的利益相關者參與該過程至關重要。AREM SME團隊需要包括多個部門的代表,最重要的是,需要包括那些在GMP生產環境中執行無菌過程的人員。例如,SME團隊可以由MSAT、生產、QA及QC組成。此外,風險評估小組隊長既接受過 QRM 原則的培訓,也接受過特定的 AREM 工具方法的培訓,才能領導團隊成員。一旦團隊成立,AREM 的準備階段就可以開始了。
范圍設置是 AREM 的重要步驟,風險評估小組將在此定義無菌生產過程的邊界——評估范圍將從何處開始,到何處結束。通常,AREM 將涉及對產品流路徑或加工物料暴露于環境或產品流路以任何方式中斷的任何步驟的操作。應討論工藝步驟(如流路的無菌焊接)是否在范圍內或超出范圍,并明確捕捉作為工作的假設。下面捕獲了可以包含在 AREM 范圍內的流程步驟或單元操作的其他示例:
可以使用AREM評估的流程步驟/單元操作示例:
· 在開放式系統中執行手動操作(B 級潔凈室內的BSC)→ 在封閉系統(C級潔凈室內的培養箱)中執行手動操作
· 用于制備工藝溶液(培養基)的無菌手動連接--通過0.2 μm過濾器過濾培養基
· 使用“現成的”醫用管道和連接器--定制設計和滅菌的組件
· 確定在裝置操作后進行過程微生物檢測(例如,微生物負荷、無菌)的需求,并執行一系列高風險的工藝步驟。
最后,AREM風險評估小組應收集重要信息,以輸入到記錄中。在此階段執行的最有用的活動之一是過程演示。由經驗豐富的人員演示無菌操作對于整個團隊的理解非常重要,從而可以更好地對風險因素進行評分。這可以通過在開發實驗室甚至會議室中模擬無菌處理步驟來實現,例如,使用注射用水代替產品和工藝溶液進行無菌操作。如果有的話,來自實際生產區域的這些無菌操作的視頻也可以提供信息。
第2步:確定在無菌邊界內執行的所有無菌步驟
工作會議開始后要執行的第一項活動應該是確定使用該工具評估范圍內的所有無菌步驟。風險評估小組應通過逐步審查每個批次記錄(如果有)來執行此任務,以確定執行的每個單獨的無菌操作。在預工作階段執行的過程的演示也有助于確定此列表。
第3步:對每個因子的每個單獨操作進行評分
一旦確定,每個無菌操作都需要由風險團隊進行評分,以確定一個操作相對于為該過程執行的所有其他操作的相對風險。給定過程的所有無菌操作都將使用相同的標準進行評分,風險評估小組應在開始評估之前達成一致。考慮無菌操作總體風險的因素是該操作的各個方面,這些方面能夠增加污染事件的可能性,或者如果引入污染物,這些因素會放大對產品或中間體的后果。在確定無菌操作的總體風險時被認為至關重要的因素可以在下表 1 中找到,各個評級標準可以在表2 中找到。
表 1:AREM 考慮的無菌操作因素

表 2: AREM 中使用的因素的風險分級

第 4 步:使用 AREM 矩陣確定每個操作的總體風險評分
風險評估小組將能夠通過將風險因素評分輸入到AREM方法中來確定每個單獨的無菌操作的總體風險。三因素評分需要采用雙矩陣方法;第一個矩陣將復雜性和操作時限評級相結合,生成一個初始風險值),該值與鄰近度評級一起輸入到最終矩陣中,以確定總體風險值。用于確定初步風險值的初步 AREM 矩陣如下表 3 所示:
表 3: 用于確定初始風險等級的初步矩陣
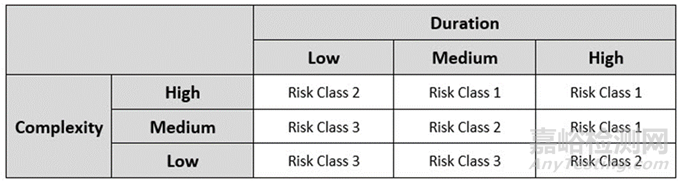
最終風險矩陣將每個無菌操作的初始風險值與其鄰近評級相結合,以確定操作的總體風險值。最終的風險矩陣見下表 4。
表 4: 用于確定總體風險評分的最終矩陣
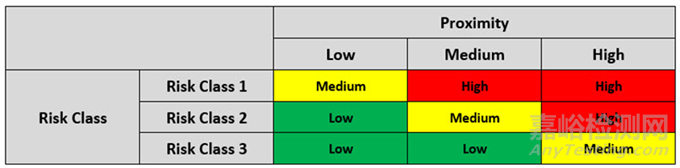
在確定總體風險評分后,將按風險對無菌程序進行排序,并采取具體措施,如表4所示。
第 5 步:確定風險可接受性和風險緩解措施(如果需要)
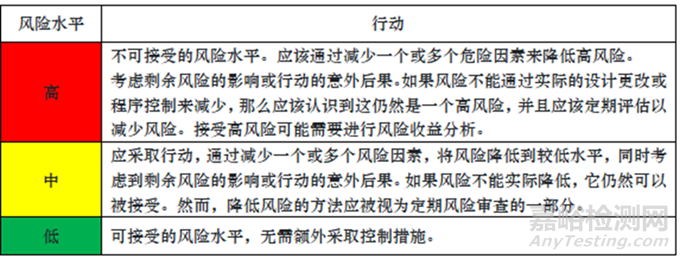
風險評估小組現在可以使用每個單獨的無菌操作的總體風險評分來確定每個操作在風險方面的可接受性(例如,它們是否適合在此過程中執行,是否需要改進才能繼續等)。為此,必須在所有評級操作中一致且統一地采用風險可接受性表。參閱下表 5,了解建議的 AREM 風險可接受性表。
表 5: 基于總體風險評分的風險可接受性表
第 6 步:AREM 的輸出 – 記錄評估和戰略輸出項目
根據風險評估結果,輸出下列行動(僅舉例):
(1) 通過減少不可接受的高風險操作來優化無菌工藝,而不是等待APS過程中不可避免的故障發生,甚至更糟的是,在產品生產過程中。
(2) 告知基于風險的方法對操作人員進行無菌工藝的培訓和資格認定——重點關注最關鍵的方面,以證明執行這項重要工作的人員對無菌的適當理解。
(3) 建立適當的標準操作程序和生產批記錄,用于常規cGMP生產處理。
結論
AREM風險評估工具應在生產過程的整個生命周期內進行管理。所有相對風險較高的無菌操作的進一步開發和設計可能需要時間和資源。出于這個原因,高風險步驟必須是無菌培訓的重點,并且必須證明將要執行這些無菌操作的每位員工都通過了資質認定。

來源:Internet


