近日,廣東省藥品監(jiān)督管理局發(fā)布關(guān)于優(yōu)化新版GB9706系列標(biāo)準(zhǔn)建議及審評(píng)審評(píng)有關(guān)工作的通知���,內(nèi)容如下:
各地級(jí)以上市市場(chǎng)監(jiān)督管理局,省藥品監(jiān)管局各有關(guān)直屬事業(yè)單位,各有關(guān)單位:
為穩(wěn)步推進(jìn)GB 9706.1-2020《醫(yī)用電氣設(shè)備 第1部分:基本安全和基本性能的通用要求》及配套并列標(biāo)準(zhǔn)�、專(zhuān)用標(biāo)準(zhǔn)(下稱(chēng)新版標(biāo)準(zhǔn))實(shí)施�����,貫徹“放管服”改革精神,現(xiàn)就我省第二類(lèi)醫(yī)療器械延續(xù)、變更注冊(cè)事項(xiàng)執(zhí)行新版標(biāo)準(zhǔn)有關(guān)事宜通知如下�����。
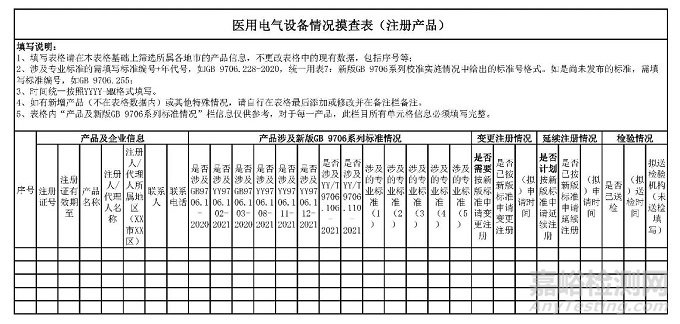
一�����、開(kāi)展標(biāo)準(zhǔn)執(zhí)行情況摸查����。各市局落實(shí)屬地監(jiān)管職責(zé),按照省藥品監(jiān)管局下發(fā)的轄區(qū)內(nèi)已獲準(zhǔn)注冊(cè)產(chǎn)品清單���,組織對(duì)轄區(qū)內(nèi)產(chǎn)品的標(biāo)準(zhǔn)適用情況,以及檢驗(yàn)��、注冊(cè)或備案進(jìn)展及計(jì)劃進(jìn)行全面摸查�����,填寫(xiě)《醫(yī)用電氣設(shè)備情況摸查表》(見(jiàn)附件1),并于4月10日前反饋至省藥品監(jiān)管局行政許可處。
二��、并聯(lián)開(kāi)展延續(xù)與變更注冊(cè)���。延續(xù)注冊(cè)時(shí)��,申請(qǐng)人為滿(mǎn)足強(qiáng)制性新版標(biāo)準(zhǔn)要求����,在產(chǎn)品未發(fā)生變化的情況下���,可以同時(shí)提出變更產(chǎn)品技術(shù)要求�。申請(qǐng)人應(yīng)當(dāng)提供相關(guān)聲明,并詳細(xì)列明新舊產(chǎn)品技術(shù)要求內(nèi)容變更的對(duì)比表。有關(guān)辦理時(shí)限按照變更注冊(cè)要求執(zhí)行���。
三、實(shí)施審檢聯(lián)動(dòng)。申請(qǐng)人在提交注冊(cè)申請(qǐng)時(shí),除未完成檢驗(yàn)外����,其他符合受理?xiàng)l件的�,可提交符合新版標(biāo)準(zhǔn)的書(shū)面承諾(見(jiàn)附件2)進(jìn)行受理����。受理后實(shí)行審檢聯(lián)動(dòng)、邊審邊檢,在補(bǔ)正資料時(shí)限內(nèi)補(bǔ)充完整的產(chǎn)品檢驗(yàn)報(bào)告���。
檢驗(yàn)報(bào)告類(lèi)型為自檢報(bào)告或委托檢驗(yàn)報(bào)告的,審評(píng)中根據(jù)需要告知補(bǔ)正部分或全部項(xiàng)目的檢驗(yàn)內(nèi)容。按照免征類(lèi)型申請(qǐng)注冊(cè)檢驗(yàn)的,應(yīng)憑注冊(cè)受理通知書(shū)向相應(yīng)檢驗(yàn)機(jī)構(gòu)申請(qǐng)。
注冊(cè)檢驗(yàn)結(jié)論不合格的�,必要時(shí)開(kāi)展注冊(cè)質(zhì)量管理體系核查���,核查不通過(guò)的�,按不予注冊(cè)處理���。
四�、其他要求
(一)各市局組織做好轄區(qū)內(nèi)企業(yè)的全覆蓋培訓(xùn)�����,督促企業(yè)對(duì)照新版標(biāo)準(zhǔn)要求����,充分開(kāi)展產(chǎn)品驗(yàn)證工作����,確保送檢樣品合格。
(二)對(duì)同一注冊(cè)單元內(nèi)包含多個(gè)型號(hào)的��,注冊(cè)申請(qǐng)人需提供典型產(chǎn)品的選擇說(shuō)明����,所檢驗(yàn)型號(hào)產(chǎn)品需是同一注冊(cè)單元內(nèi)能夠代表其他型號(hào)產(chǎn)品安全性和有效性的典型產(chǎn)品,否則還應(yīng)選擇其他型號(hào)進(jìn)行差異性檢驗(yàn)���。
本項(xiàng)工作自通知印發(fā)之日起試行,試行期至2023年12月31日止�����。試行期間如國(guó)家另有規(guī)定����,按其規(guī)定執(zhí)行。各相關(guān)單位工作中如遇問(wèn)題���,請(qǐng)及時(shí)向省藥品監(jiān)管局行政許可處反映���。聯(lián)系人及聯(lián)系電話:田小俊、易準(zhǔn)�,020-37886591����、37885802��。
廣東省藥品監(jiān)督管理局辦公室
2023年3月24日
附件1.醫(yī)用電氣設(shè)備情況摸查表

附件2. 承諾書(shū)
承諾書(shū)
本公司(單位)申請(qǐng)辦理 (產(chǎn)品名稱(chēng))第二類(lèi)醫(yī)療器械注冊(cè)證 事項(xiàng)?���,F(xiàn)就相關(guān)事宜作出如下承諾:
一���、已經(jīng)知曉《廣東省藥品監(jiān)督管理局關(guān)于優(yōu)化新版GB 9706系列標(biāo)準(zhǔn)檢驗(yàn)及審評(píng)審批有關(guān)工作的通知》的全部?jī)?nèi)容���;
二��、產(chǎn)品符合新版GB 9706系列標(biāo)準(zhǔn)要求��;
三、在補(bǔ)正資料時(shí)限內(nèi)補(bǔ)充完整的產(chǎn)品檢驗(yàn)報(bào)告(□自檢報(bào)告 □委托檢驗(yàn)報(bào)告 □免征類(lèi)型注冊(cè)檢驗(yàn)報(bào)告)��;
四�����、在未能取得正式批準(zhǔn)文件之前�����,承諾不開(kāi)展相關(guān)生產(chǎn)活動(dòng);
五����、所作承諾是真實(shí)意思表示����,提供的所有申請(qǐng)材料真實(shí)有效�,愿意承擔(dān)失信產(chǎn)生的后果��。
承諾單位(蓋章):
法定代表人(簽字):
年 月 日





