您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-07-04 08:36
幾十年來,許多亞硝胺被認為是致癌的。盡管幾種亞硝胺前體經常用于藥物產品的制造,但由于缺乏對它們在制造過程中如何形成的了解,它們在藥物產品中的潛在存在以前被忽視了。從風險評估可以清楚地看出,亞硝胺或其前體可能存在于成品劑型的任何組分中。作為風險緩解策略,應避免使用極有可能形成亞硝胺的成分。在沒有合適替代品的情況下,必須采取足夠的措施將亞硝胺維持在可接受的攝入量以下。必須廣泛研究賦形劑生產途徑,以確定可能導致亞硝胺形成的可能賦形劑成分。制造商不得僅依賴原料藥和輔料的藥典規范,還應制定和實施額外的策略來控制亞硝胺雜質。該制劑可以補充亞硝化抑制劑,如維生素C,以停止亞硝胺的產生。本綜述的目的是確定藥物劑型中亞硝胺形成的關鍵風險因素,并提供有效的控制策略,將其控制在可接受的每日攝入量限值以下。
1.介紹
已知許多亞硝胺具有致癌活性。各種組織已經認識到N-亞硝基二甲胺(NDMA)作為人類誘變致癌物的作用。此外,導致它們產生的機制甚至在20世紀50年代之前就已為人所知。盡管如此,考慮到許多亞硝胺前體(磺胺類抗生素、二甲雙胍和N,N二甲基甲酰胺(DMF)通常用于其產品中,制藥工業和監管機構都沒有意識到它們在藥品中存在的高可能性準備。一個顛覆性事件(纈沙坦召回)動員了行業并制定了新的監管策略來控制藥品中亞硝胺的存在。因此,在2018年,當纈沙坦片中檢測到濃度可能對人類構成風險的NDMA水平時,就拉響了警報,引發了纈沙坦片劑的召回。隨后,在纈沙坦片中發現了其他值得關注的亞硝胺雜質,如N-亞硝基二乙胺(NDEA),在氯沙坦片中發現了N-亞硝基-N-甲基-4-氨基丁酸(NMBA)。
最初,這些雜質被認為與血管緊張素II受體阻滯劑(ARB)中四唑環形成的特定制造過程有關。然而,當在二甲雙胍、雷尼替丁和尼扎替丁等非ARB分子中也發現NDMA時,這一假設很快就失效了。在適當的時候,利福平和利福噴丁中也分別報告了1-甲基-4-亞硝基哌嗪(MNP)和1-環戊基-4-亞硝基哌嗪(CPNP)(表I),表明不同的制劑成分可能有助于藥物中亞硝胺的產生產品。這意味著亞硝胺可以存在于典型劑型的任何組分中,包括活性藥物成分(API)(特別是具有胺官能團的那些)、賦形劑、加工助劑、溶劑、試劑、再循環溶劑(含亞硝酸鈉的DMF)、包裝材料、制造設備和制造工藝。
表1: 制劑中檢出/報告的潛在N-亞硝胺雜質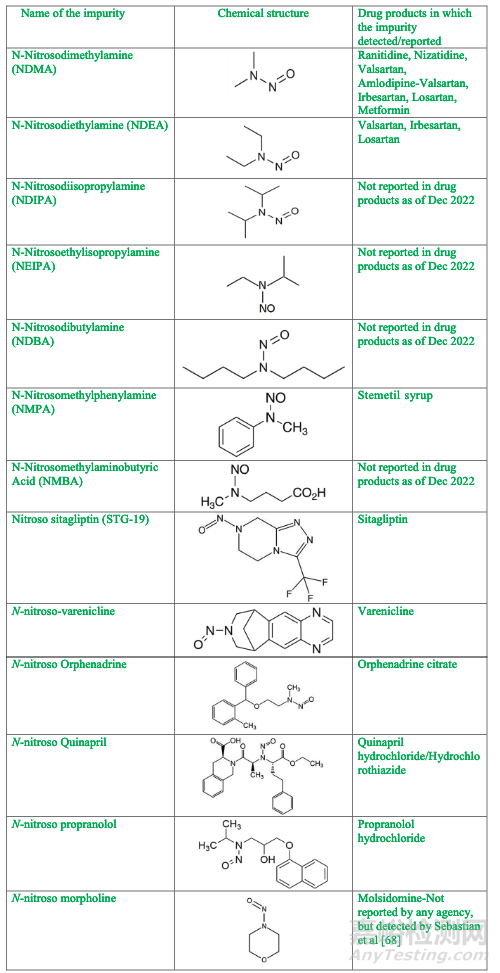
2.N-亞硝胺生物活化機理
NDMA和其他N-亞硝基二烷基胺的致突變性和遺傳毒性歸因于它們通過細胞色素P450催化的一系列反應轉化為烷基重氮離子和烷基碳離子。N-亞硝胺本身不致癌。由于它們在生理pH下的穩定性,它們需要代謝活化。細胞色素P450依賴性酶引起涉及幾個步驟的生物活化。活化通過α-碳的羥基化引發,隨后醛的自發損失或形成亞硝胺。亞硝胺在生理條件下也是不穩定的,并且非酶分解成碳正離子或重氮化合物(圖1)。這兩種化合物都能夠烷基化各種細胞大分子,如DNA、RNA和染色體,形成加合物。鳥嘌呤的N-7烷基化導致DNA的不穩定和斷裂增加。因此,由此產生的DNA損傷導致癌癥。具有可氧化碳中心α至亞硝基的N-亞硝胺似乎是代謝依賴性致癌性的關鍵要求。此外,活化亞硝胺增加通過增加活性氧如超氧化物和過氧化氫的產生從而增加脂質過氧化和蛋白質加合物形成的氧化應激。
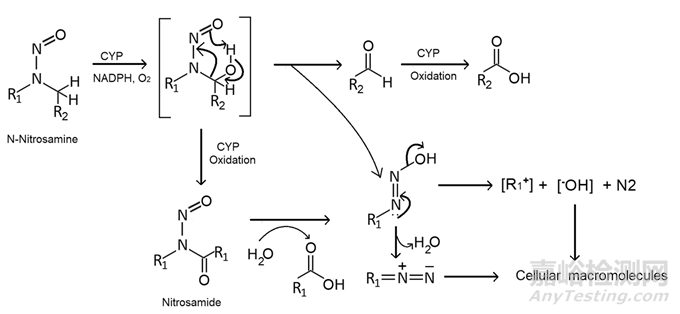
圖1 亞硝胺雜質的生物活化機理
3.亞硝胺形成機理
亞硝化反應在亞硝化劑的存在下進行,并且該反應通過有利的化學環境條件如介質的pH和胺的pKa的存在而促進。在胺中,仲胺表現出形成亞硝胺的最高潛力。亞硝酸鹽和硝酸不直接參與亞硝化反應,而是在兩個平衡步驟中轉化為亞硝化劑。首先,亞硝酸根離子(NO2)被質子化形成亞硝酸(HNO2),亞硝酸可以與作為亞硝化劑的無水三氧化二氮(N2O3)處于平衡狀態。反應在酸性條件下以更快的速度進行。在第二步中,胺的去質子化在較高pH下進行。該反應的速率取決于胺的濃度和亞硝酸鹽濃度的平方(圖2)。另一方面,反應性較低的氨基化合物不與N2O3反應,但可以與在低pH下由硝酸產生的亞硝基離子(NO+)反應,其速率取決于胺化合物的濃度、亞硝酸鹽濃度和水合氫離子濃度(圖2)。胺(堿性氮)的pKa對反應速率的作用可以從胺的未質子化形式顯示的事實推斷出來與亞硝化劑反應的高度傾向。例如,pKa為5.1的氨基比林顯示出比pKa為10.7的二甲胺(DMA)更大的反應性。
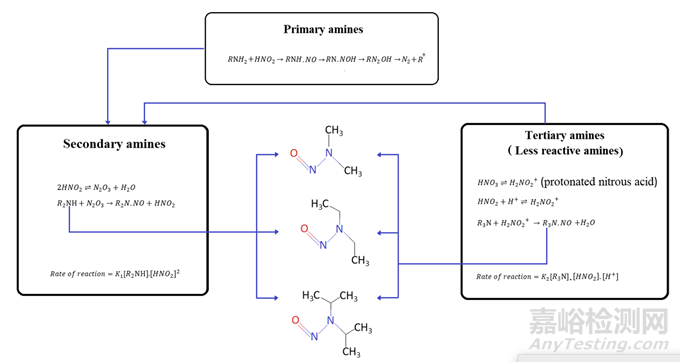
圖2 亞硝胺雜質形成機理
在叔胺的情況下,還提出了NDMA形成的四步機制。氯胺親核取代之后是氧化、脫水和亞硝化。亞硝化是該序列中的限速步驟,并控制叔胺中的NDMA水平。此外,在DMA部分旁邊具有官能團如芐基、芳族雜環和二烯取代的亞甲基的叔胺可以作為NDMA的重要前體[23]。在雷尼替丁的情況下,King等人。表明雷尼替丁的分子間反應導致雷尼替丁的緩慢降解,導致NDMA的形成,而不涉及雜質。影響降解速率的風險因素是熱、濕度和晶體形態。其他作者得出結論,儲存環境、固態形式和制劑成分也可能導致NDMA的產生。
類似地,亞硝胺也可以在環境室溫(25°C)下在接近中性和堿性條件(pH 6-14)下形成,這表明當暴露于被二氧化氮污染的空氣時,在生理pH下,如在肺部,有產生亞硝胺的風險。然而,在這些條件下的亞硝化以與上述不同的機制進行,涉及亞硝化劑二氧化氮或其平衡對應物N2O3和N2O4氣體。此外,高溶解度親脂相中的游離胺堿(反應性更強的形式)可以在生理條件下增強亞硝胺的形成,而不依賴于pH。
值得注意的是,服用低劑量(mg/Kg)纈沙坦的患者終生癌癥風險被確定為低。例如,EMA(歐洲藥品管理局)計算出服用含有NDMA(6年)和NDEA(4.6年)的纈沙坦的患者的癌癥發展的累積終生風險為0.03%,最高日劑量為320 mg。與歐盟約50%的終生癌癥風險相比,這種超額風險非常低。
4. 亞硝胺形成的風險因素
胺
仲胺和叔胺以及仲酰胺顯示出經歷亞硝化反應的趨勢,盡管程度不同。具有二烷基、二芳基、烷基芳基、N-烷基脲、環狀仲胺、N-烷基氨基甲酸酯和N-烷基酰胺等官能團的藥物高度敏感,可形成亞硝胺。除了活性藥物成分(API)之外,胺也可以通過起始材料、中間體、試劑、催化劑、酰胺溶劑和存在于酰胺溶劑中的仲胺雜質(例如:DMA雜質在DMF中)。當長時間加熱時,酰胺溶劑如DMF、N-甲基吡咯烷酮、N,N-二甲基乙酰胺和N,N-二乙基乙酰胺會降解并形成仲胺。類似地,叔胺試劑如三甲胺可以含有痕量的仲胺如二丙胺和異丙基乙胺,而季胺試劑如四丁基溴化銨已被證明降解為仲胺(二丁胺雜質)和叔胺(三丁胺雜質)。
殘余胺也可以存在于回收的溶劑、試劑和催化劑中。事實上,亞硝胺可能在回收過程本身中形成。例如,在回收過程中用亞硝酸淬滅疊氮化二鈉會導致亞硝胺的形成。根據它們的沸點和溶解度特性,隨后的純化步驟可能不會完全去除它們。不完善的生產工藝以及不充分的過程控制(如pH、溫度等)也會導致亞硝胺的形成。
亞硝化劑來源
像亞硝酸鈉這樣的亞硝酸鹽通常被添加到肉類中,要么是為了增強其感官吸引力,要么是為了保存。此外,制造過程如發酵可誘導硝酸鹽和其它氮源如氨基酸轉化為亞硝酸鹽形式。吸煙、環境污染等也可產生高活性亞硝化劑如氮氧化物。如上所述,氣態形式N2O3和NO2甚至可以在生理條件下導致亞硝胺的形成。一種底物的亞硝基通過轉亞硝化作用甚至可以在與具有形成亞硝胺潛力的另一底物接觸時觸發亞硝胺的形成。
硝酸鹽和亞硝酸鹽也以足以促進亞硝化反應的水平存在于人唾液和胃中。眾所周知,水果和蔬菜、加工食品(肉類)和水中存在硝酸鹽。此外,亞硝酸鹽和硝酸鹽也可以內源性產生。因此,必須將藥品亞硝胺暴露的影響與膳食亞硝胺進行比較,并評估是否存在任何顯著差異。糧農組織(糧食及農業組織)/世衛組織(世界衛生組織)食品添加劑聯合專家委員會(JECFA)建議硝酸鹽的可接受日攝入量(ADI)為3.7毫克/千克/天,相當于60公斤的人每天222毫克硝酸鹽。每天400克(蔬菜和水果)的均衡飲食暴露量相當于大約157毫克/天的硝酸鹽。
輔料
微量的亞硝化雜質(亞硝酸鹽和硝酸鹽)也存在于常用的賦形劑中,包括預膠化淀粉、聚乙烯吡咯烷酮、交聯羧甲基纖維素鈉、淀粉乙醇酸鈉、交聯聚乙烯吡咯烷酮和乳糖。輔料中這些雜質的來源可以追溯到加工用水和生產工藝,尤其是涉及使用酸和漂白劑的工藝。干燥過程中的氧化是一種高風險事件,最終會形成亞硝胺。在二甲雙胍片劑的情況下,已經表明工藝參數(水和熱)以及輔料的硝酸鹽和亞硝酸鹽含量的共存在NMDA的產生中起著關鍵作用[29]。鑒于二甲雙胍的主要緩釋劑量制劑已被召回,似乎含有較高水平亞硝胺雜質并經常用于緩釋制劑中的纖維素基聚合物顯著有助于這些制劑的較高亞硝胺負載。
受污染的原材料也可能是亞硝胺雜質的來源。污染可以通過各種方式發生,包括儲存容器之間的轉移,具有硝酸鹽部分的原材料(如硝酸鉀)通常含有亞硝酸鹽雜質,以及由于低效的清潔過程而來自其他亞硝胺生成過程的交叉污染。這凸顯了嚴格控制原材料供應鏈的必要性。清潔驗證計劃應考慮亞硝胺交叉污染的風險。
減少/消除亞硝胺形成的控制策略
藥品的有效控制策略應考慮所有成分,即活性藥物成分(API)、賦形劑、包裝材料和制造工藝[14](圖3)。FDA(美國食品藥品監督管理局)和EMA建議采取三步法控制藥品中的亞硝胺雜質。
步驟1(風險評估):如果API、已上市產品或待批準產品中懷疑存在亞硝胺雜質,則進行風險評估。應優先選擇亞硝胺污染風險高的藥品。
步驟2(確認):如果產品中存在亞硝胺形成的可能性,則進行確認測試應使用具有可接受的專屬性、色譜分離和檢測能力的分析方法進行(對于高劑量產品,LOD(檢測限)和LOQ(定量限)應盡可能低)。
步驟3(監管溝通):如果污染物超過ADI閾值,應向監管機構發出警報,并調整制造方法。應制定有效的控制策略以降低風險。應評估由此產生的變更對已批準申請的影響,并根據情況更新監管提交的文件。
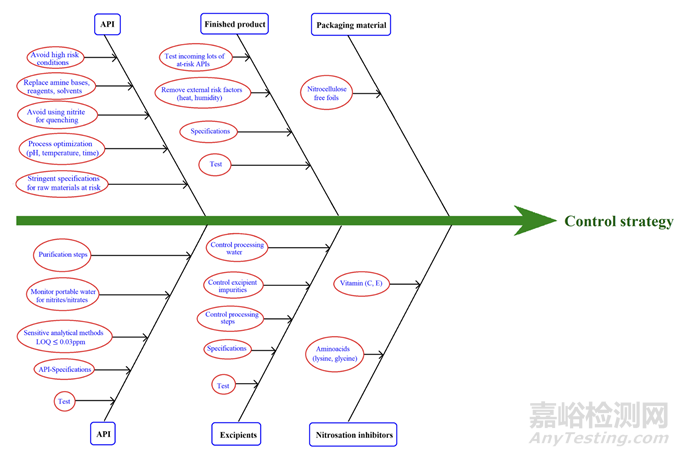
圖3制劑中亞硝胺雜質的風險評估
活性藥物成分
FDA建議采取以下步驟來減輕和控制API中亞硝胺的存在
解決方式:
應避免產生亞硝胺的可能性高的反應條件。如果替代路線或條件無法部署;然后,必須實施適當的控制措施,以確保亞硝胺水平始終降低到可接受水平以下
如果合成路線正在產生亞硝胺;然后,仲胺、叔胺或季胺必須用其他(替代的)堿代替
無論何時使用酰胺溶劑,都必須格外小心
在疊氮化物分解操作中,不應使用亞硝酸鹽作為猝滅劑
必須設計和優化工藝,對反應順序、工藝和反應條件(如pH、溫度和反應時間)有足夠的控制
必須包括去除亞硝胺污染物的下游加工方法
應從主反應混合物中去除猝滅步驟。相反,疊氮化物應該從母液中分離到有機相中,然后從有機相中分離含水廢物相,然后可以在沒有猝滅劑與API接觸的風險的情況下猝滅
原材料、起始材料、中間體、試劑,溶劑等供應鏈中,如有必要,必須采取額外的控制措施,如對有風險的原材料制定嚴格的質量標準
必須實施控制措施,使回收的材料僅用于收集材料的同一步驟或同一工藝的較早步驟。這將有助于防止交叉污染。此外,回收的材料在再利用之前應符合嚴格的規格。外包承包商進行的回收需要這些實驗室必須遵守的一系列嚴格要求,包括清潔程序的驗證和質量體系的監控
應監測合成中使用的便攜式水的硝酸鹽和亞硝酸鹽。如果需要,應在使用前對水進行凈化
可進行再加工和返工以控制亞硝胺水平
控制策略
如果API中檢測到高于LOQ的亞硝胺,則應制定控制措施。用于此目的的分析方法應非常靈敏,LOQ≤0.03 ppm[30]。對于高劑量API,方法的LOD和LOQ應盡可能低。如果存在一種以上的亞硝胺,則需要經過驗證的分析方法,LOQ甚至低于0.03 ppm。
有效的控制策略應包括質量標準限度,以確保亞硝胺水平保持在ADI限度以下。如果產品中檢測到的亞硝胺水平高于LOQ,則應對每批產品進行檢測。不應放行亞硝胺水平高于ADI的API批次。FDA應該被告知上市產品中亞硝胺的存在,這一點怎么強調都不為過。根據臨床結果和產品停產的風險,FDA偶爾會同意亞硝胺含量大于ADI的批次仍可使用。例如,一些銷售含有1-甲基-4-亞硝基哌嗪(MNP)的利福平或含有1-環戊基-4-亞硝基哌嗪(CPNP)的利福噴丁(CPNP)高于可接受攝入量限值(MNP為0.16 ppm,CPNP為0.1 ppm)的制造商被允許暫時銷售產品,直到他們減少或消除雜質,前提是MNP和CPNP水平分別低于5 ppm和14 ppm。
制劑
與API的情況一樣,FDA提出了成品的三步風險評估方法。藥品制造商應與API制造商密切合作,確定合成路線的潛力,并產生亞硝胺的加工條件[30]。正如雷尼替丁的案例所示,風險評估還應考慮API在生產或儲存過程中可能導致亞硝胺形成的降解途徑[25]。在不存在風險的情況下,無需采取進一步措施。另一方面,如果確定制劑中存在亞硝胺的風險,則應使用經驗證的分析方法對批次進行確認性檢測。如果在成品中檢測到亞硝胺,應調查根本原因并改變生產工藝以減輕或減少亞硝胺雜質。
藥品生產企業采取的控制策略應包括以下內容:
在使用任何來料成分(包括大量風險API)之前,藥品制造商必須測試所有來料成分的代表性樣品并繼續測試API批次,直到他們驗證API供應商能夠始終如一地生產API而不含不可接受水平的亞硝胺
評估是否在使用風險API的制造過程中可能存在亞硝酸鹽
評估在藥品有效期內成品中是否可能形成亞硝胺
如果外部因素導致亞硝胺污染,應消除污染源
如果亞硝胺雜質高于LOQ,則需要采取策略將亞硝胺水平控制在ADI限值以下。控制策略應包括確定的亞硝胺的質量標準限度,以及確定是否由于API結構、API合成路線或API或制劑的生產工藝而固有引入亞硝胺。每個批次都應進行檢測
任何發現亞硝胺雜質含量等于或高于推薦ADI的藥品批次均不應由藥品制造商放行進行分銷,除非FDA基于藥品短缺對患者的嚴重影響而同意暫時允許此類產品的分銷
根據上述建議,以下章節討論了常用藥品中亞硝胺的控制策略。
鹽酸二甲雙胍
二甲雙胍由DMA鹽酸鹽和2-氰基胍合成。因此,殘留的DMA可被帶入API,因此API被控制在不超過0.05%的水平。然而,即使在這種低濃度下,它也會產生亞硝胺雜質在與含有亞硝化劑的賦形劑接觸時。因此,消除或限制API中殘留的DMA可以顯著降低亞硝胺生成的風險(圖4)。幸運的是,NDMA表現出高水溶性和高揮發性,這有利于其在下游結晶和干燥過程中的去除。由于它們的離子特性,亞硝酸鹽和DMA在水相中的分配進一步促進了它們的去除。DMA、亞硝酸鹽和NDMA的水/二氯甲烷分配系數(log P)分別為-4.75、-2.89和-0.54。事實上,實踐表明,在下游過程中,NDMA可以降低到<1 ng/g的水平。因此,采用純化步驟如多個結晶步驟可以從NDMA中釋放二甲雙胍API。考慮到產品中30 ng/g的適用限度,二甲雙胍API的貢獻可以忽略不計。與NDMA一樣,DMA水平可在多個純化步驟期間降低至10-100 μ g/g的水平。為了控制API中的DMA水平,使得未來批次中的NDMA低于ADI的30%,進行了API DMA水平與NDMA濃度之間的線性回歸分析。作者提出DMA的內部控制限度為60 μ g/g作為二甲雙胍片的控制策略。
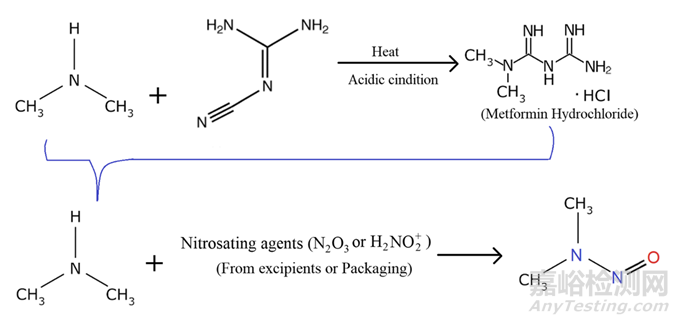
圖4: 二甲雙胍中N-亞硝基二甲胺的生成機理
考慮到前面的討論以及大多數二甲雙胍緩釋劑型被召回的事實,二甲雙胍API的風險微不足道。事實上,已經證明通常用于控制藥物釋放的賦形劑,如HPMCE4和HPMC K15,含有高亞硝胺水平,并有助于二甲雙胍緩釋制劑中較高的亞硝胺水平。
雷尼替丁
雷尼替丁含有叔胺基團,在固態和液態下都缺乏穩定性。而且,雷尼替丁易于光介導降解,導致乙醛肟、噻唑、DMF、二甲基乙酰胺、5-甲基糠醛和其他降解產物的形成氣相色譜法在測定雷尼替丁原料藥和雷尼替丁片劑中的NDMA水平方面無效,因為該方法沒有選擇性,峰分辨率較差,導致NDMA水平較高。FDA推薦了一種替代的、經過驗證的液相色譜和高分辨率質譜光度計方法(LC-HRMS),該方法可防止雷尼替丁降解和隨后NDMA的形成。該方法的LOD為0.011 ppm,LOQ為0.033 ppm。
接近到期的產品顯示出比新產品更高的NDMA水平,表明降解是NDMA形成的原因。雷尼替丁粉末和片劑中的NDMA水平在加速條件(40℃/75%相對濕度)下分別從0.19 ppm增加到116 ppm和從2.89 ppm增加到18 ppm,超過了FDA為雷尼替丁片劑設定的0.32 ppm的每日攝入限值(1 g雷尼替丁中存在0.32 μ g NDMA或300 mg/天雷尼替丁最大日劑量中存在0.096 μ g NDMA)。
當外推至室溫條件時,這代表了顯著的風險。強制降解研究表明,氧化和水分可能是導致NDMA增加的因素。已經提出了雷尼替丁中NDMA形成的各種其他機制。雷尼替丁會發生自我分解,導致儲存過程中亞硝酸鹽濃度增加。反應速率受熱、濕度和晶體形態的影響。柱狀晶體顯示出較慢的降解速率。雷尼替丁釋放的DMA在與亞硝化劑接觸時也可能導致NDMA的形成。類似地,水的氯胺化也被認為是雷尼替丁片劑中亞硝胺形成的來源。一些報道甚至表明,口服雷尼替丁后,胃腸道中存在的亞硝酸鹽導致體內NMDA的形成。
Yokoo等人進行的強制降解研究表明,除了雷尼替丁之外,雜質A、C、D、E、H和I在固態或液態下以不同的速率產生NDMA。USP(美國藥典)和EP(歐洲藥典)規定了雷尼替丁中的11種雜質(A、B、C、D、E、F、G、H、I、J和K)(表2)。雜質A、C、D、E和I含有DMA和/或N,N二烷基-2-硝基乙烯-1,1-二胺基團。有趣的是,不含胺部分的雜質H也導致固態NDMA的形成,表明NDMA形成的不同途徑。作者認為,雜質H的N-甲基的水解產生甲胺,甲胺與硝基甲烷(通過雜質H的水解和脫羧形成)反應形成DMA和亞硝酸,亞硝酸反應形成NDMA。無定形雜質A、C和E導致以比結晶鹽酸雷尼替丁高約100倍的速率形成NDMA。雜質I顯示出在中等溫度下形成NDMA的潛力。因此,必須嚴格控制這些雜質。Yokoo采用的分析方法類似于FDA推薦的方法,即LC-HRMS,但有一些微小的變化。
表2: 雷尼替丁中的雜質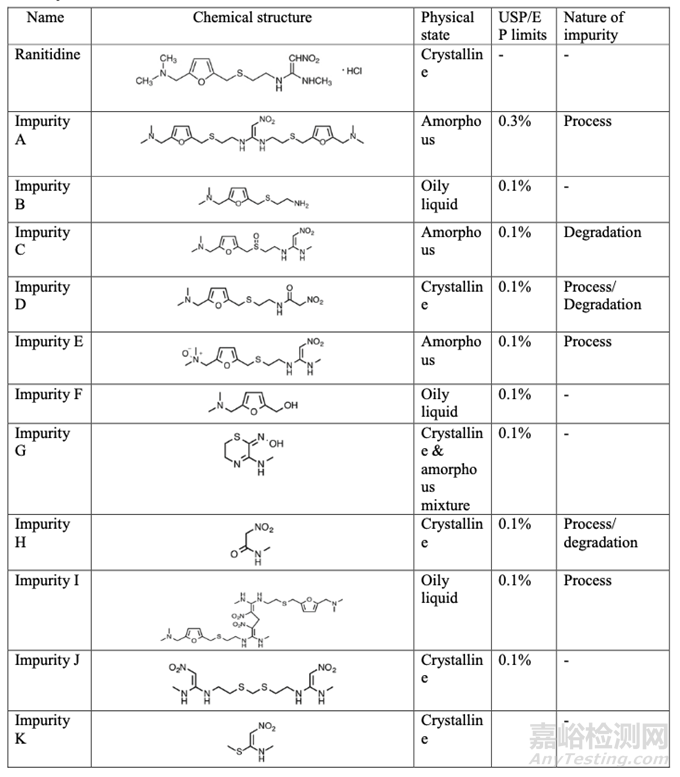
沙坦類藥物
沙坦類藥物中亞硝胺的存在可追溯到四唑環形成過程中使用的試劑、溶劑、催化劑和反應條件。大多數已獲得上市許可的產品中使用的API是通過使用遺傳毒性疊氮化物試劑(疊氮化鈉)合成的,該試劑在酸性條件下用亞硝化劑(亞硝酸鈉)猝滅(圖5)。使用催化劑如路易斯酸來加速反應。此外,大量的試劑、高溫條件和溶劑(DMF、二甲基亞砜和N-甲基吡咯烷酮(NMP)以及與它們相關的雜質)提供了亞硝胺形成所需的合適環境。后來證實,可以通過在猝滅前分離原料藥來防止亞硝胺的形成。
發現亞硝胺的形成通過兩種途徑產生。在一種途徑中,DMF和N-甲基吡咯烷酮由于水解和/或熱介導的降解分別形成仲胺,即DMA和4-甲基氨基丁酸。隨后,DMA和4-甲氨基丁酸與亞硝化劑反應并形成NDMA和NMBA。在第二種途徑中,試劑(三甲胺、二異丙基乙胺和DMA)經歷N-亞硝化脫烷基化,形成NDEA(N-亞硝基二乙胺)、NDIPA(N-亞硝基二異丙胺)、NEIPA(N-亞硝基乙基異丙胺)和NMPA(N-亞硝基甲基苯胺)。所有的反應物,包括溶劑、試劑和催化劑,如果被仲胺和叔胺雜質污染,會產生亞硝胺。
在某些條件下將亞硝化劑、胺衍生試劑、溶劑和催化劑結合在一起為亞硝胺的產生提供了合適的環境。這些藥物的組合代表亞硝胺形成的高風險,因此,應避免組合。
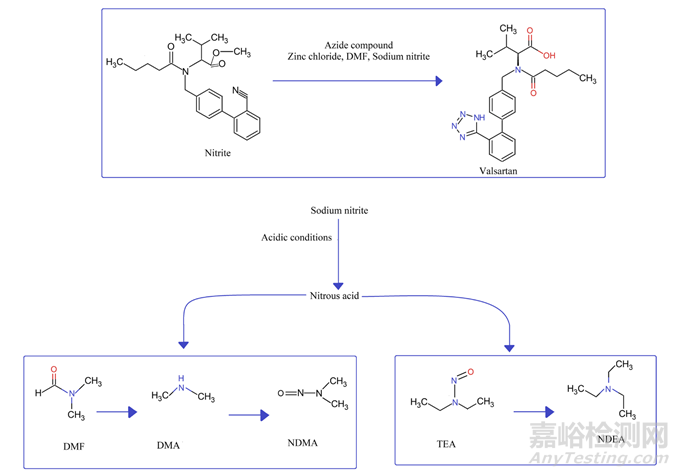
圖5:沙坦類藥物中亞硝基雜質的形成機理
吡格列酮藥物
吡格列酮通常通過兩種途徑合成。在路線I中,亞硝酸鈉用于苯胺衍生物的亞硝化重氮化,而路線II不使用任何亞硝化劑。確定根本原因是在上游工藝中使用亞硝酸鈉和溴化氫,在下游工藝中使用DMF和鹽酸,這表明在引入DMF之前,亞硝酸鈉(或另一種形式的亞硝化劑)在幾個步驟中攜帶。避免創建NDMA的一個選擇是替換DMF。
除了上述機制有助于亞硝胺形成的可能性之外,在吡格列酮的情況下,發現來自先前步驟的胺和亞硝酸鹽的殘留導致亞硝胺形成。因此,回收的溶劑、試劑和催化劑以及交叉污染(在多用途設施中)是潛在的亞硝胺來源。印度Lantech Pharmaceuticals Limited收到FDA警告信,稱該工廠回收的溶劑含有NDEA和NDMA。
賦形劑和制造工藝
候選藥物可以直接與賦形劑反應,例如在伯胺和乳糖的情況下。然而,在大多數涉及氧化降解的情況下,是輔料雜質導致了與API的反應/相互作用。與API(具有明確的組成)不同,賦形劑通常含有多種負責藥物-賦形劑相互作用的成分(圖4)。已知與API反應的主要輔料雜質是過氧化物、過氧化氫、甲醛和甲酸。因此,謹慎的做法是了解輔料的生產途徑,以識別可能與可能與API發生反應的輔料相關的潛在成分。賦形劑是合成的或源自天然來源(植物、動物和采礦)或工程(基因修飾、生物技術和配制)。通常,輔料來源決定其組成和雜質。賦形劑中存在的痕量加工助劑也可能積極參與藥物-賦形劑相互作用或可能促進這些相互作用。
在其他雜質中,硝酸鹽和亞硝酸鹽也通常存在于賦形劑中。含有痕量硝酸鹽和亞硝酸鹽的賦形劑的實例是交聯羧甲基纖維素鈉、聚乙烯吡咯烷酮、乳糖、預膠化淀粉等(圖6)。硝酸鹽和亞硝酸鹽的存在在賦形劑中也與加工水和加熱過程中的漂白和氧化等加工步驟有關。因此,含有硝酸鹽和亞硝酸鹽的輔料存在在含有胺的API的產品中產生亞硝胺的風險官能團,尤其是更易受攻擊的仲胺。
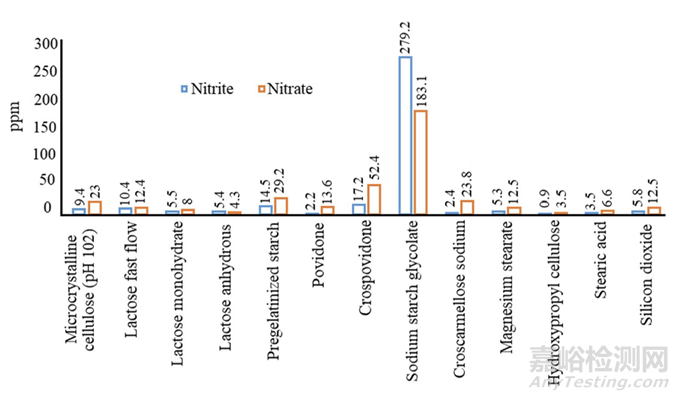
圖6:常用藥用輔料中亞硝酸鹽和硝酸鹽含量
輔料在亞硝胺形成中的作用可以通過二甲雙胍案例研究來了解。證據表明,二甲雙胍對二甲雙胍片劑中發現的NDMA水平沒有顯著影響。相反,制造過程,特別是涉及加熱和亞硝酸鹽引入的過程,會產生大量的NDMA。事實上,當輔料的亞硝酸鹽負載降低時,產品中的NDMA水平得到控制,并且已被提出為有效的控制策略。在一項這樣的研究中,Nasr等人。建議在顆粒內部分使用PVP K30作為二甲雙胍IR片劑的粘合劑,無論溶劑和干燥溫度條件如何,都可以添加該粘合劑。相反,當通過顆粒內添加羥丙基甲基纖維素(HPMC)E5(分散在水中,亞硝酸鹽負載為40ppm,硝酸鹽負載為25ppm)然后在60℃下干燥來制備制劑時,觀察到NDMA水平(0.135 ppm)的驚人增加,對應于269ng/天的日劑量,遠遠大于可接受的日攝入量。然而,當相同制劑在較低溫度(25℃)下干燥時,NDMA水平(0.034 ppm)適度增加,對應于67ng/天的日劑量。當顆粒外添加(沒有水和熱量)時,含有高水平亞硝酸鹽(100 ppm)和硝酸鹽(155 ppm)的Polytox®甚至沒有顯示出可檢測到的NDMA水平,這表明水和熱量在NDMA生成中的作用[29]。該結果在另一項研究中也得到了驗證。NDMA的增加被證明與壓縮過程中的熱量、水分和應力以及PVP K30和HPMC作為亞硝酸鹽來源有關[29]。這些研究支持了問題似乎出在控釋賦形劑(特別是纖維素基賦形劑)上的觀點,并解釋了為什么大多數召回的藥物都是控釋制劑。
輔料制造商和成品制劑制造商之間溝通的重要性怎么強調都不為過。需要密切合作來控制硝酸鹽和亞硝酸鹽的殘留水平。然而,期望輔料制造商修改其工藝以滿足制藥行業的需求是不現實的。制藥公司只占其客戶群的一小部分,一些關鍵藥物和輔料已經供不應求。因此,輔料供應商不太可能有興趣廣泛測試他們的材料的亞硝酸鹽含量。因此,客戶將不得不承擔測試的負擔,這在經濟上是不可行的。可能優選用堿性稀釋劑重新配制或添加抗氧化劑,而不是通過額外測試控制賦形劑。更好的替代方案可能是使用堿性稀釋劑或添加抗氧化劑而不是通過額外測試控制賦形劑進行重新配制。
在API合成和成品制劑生產制粒過程中通常用作溶劑的便攜式水也可能含有亞硝酸鹽和亞硝胺雜質。在制劑開發過程中選擇輔料時,應考慮輔料的硝酸鹽和亞硝酸鹽負載量并評估其影響。另一種控制策略是選擇在劑型中提供中性或堿性微環境的賦形劑,因為亞硝胺反應在酸性條件下更有利地進行。目前API和輔料的藥典規范不足以控制亞硝胺雜質。因此,API制造商和成品制劑制造商除了遵守相關藥典專論外,還必須制定和實施控制這些雜質的策略。
Lhasa Limited正在維護一個與常用輔料中亞硝酸鹽水平相關的數據庫,該數據庫使用經過驗證的分析方法進行測量。該數據庫提供了一個有用的平臺來估計輔料中存在的亞硝酸鹽對藥品中亞硝胺生成的風險。作為制劑的主要組分的稀釋劑或填充劑預期貢獻最高水平的亞硝酸鹽。幸運的是,稀釋劑含有低亞硝酸鹽水平,并顯示出不同批次間腈水平的低可變性,導致典型制劑中亞硝酸鹽的平均值為1 μ g/g。例如,對于微晶纖維素和乳糖一水合物,報告的平均亞硝酸鹽水平分別為0.70 μ g/g和0.54 μ g/g。相比之下,交聯聚維酮顯示出6.5 μ g/g的非常高的平均亞硝酸鹽水平。數據庫中報告的玉米淀粉、交聯羧甲基纖維素鈉、羥丙甲纖維素、硬脂酸鎂、聚維酮和膠體二氧化硅的平均亞硝酸鹽水平分別為0.21、0.42、0.80、2.6、0.83和1.3 μ g/g。大多數賦形劑的亞硝酸鹽水平低于10 μ g/g。數據庫可用于計算制劑中的平均亞硝酸鹽含量。
考慮到亞硝胺形成的有利條件,提出了以下方程來估計制劑中由亞硝酸鹽形成的亞硝胺的量(ng/g)。

穩定性評價
雷尼替丁案為藥品中亞硝胺的來源提供了新的線索[25]。含有不穩定胺的產品,如雷尼替丁,應在加速(40°C/75%RH)和實時穩定性設置(30°C/75%RH-IVB區為最差情況)下進行嚴格的穩定性研究。強制降解研究可用于繪制降解曲線并預測在實時儲存條件下可能產生的潛在降解雜質。例如,雷尼替丁片劑在60°C/75%RH下儲存在打開/關閉的真空小瓶中1周,表明水分、氧氣和高溫條件誘導NDMA形成[25]。同樣,Dharani等人報告了二甲雙胍速釋片和緩釋片在使用儲存條件下形成亞硝胺,這意味著風險產品的使用穩定性評估應成為正式穩定性計劃的一部分,并應提供適當的使用儲存建議,以確保使用期間藥物的安全性[50]。對于有風險的產品,在選擇包裝時必須特別小心。
在穩定性計劃中評價產品時,為該計劃選擇的輔料批次應代表典型的生產工藝。考慮到大多數亞硝胺是通過LC-MS/MS(三重四元)方法分析的,將亞硝胺測試添加到藥品所經受的一系列測試中肯定會產生成本影響。
包裝材料
在某些情況下,亞硝胺可追溯到基本包裝材料。硝化纖維素是鋁箔上使用的印刷底漆、印刷油墨和清漆的主要成分之一[37]。由于它們可以簡單地印刷在鋁箔和紙箔上,它們被廣泛用于醫藥和食品應用。起泡操作通常需要高溫(>180℃)以形成袋并在基底和蓋箔之間有效密封。高溫會導致硝化纖維素熱分解,導致硝酸(NO)和二氧化氮(NO2)的釋放,與水接觸后會形成亞硝酸【49】。亞硝酸可引起胺(例如DMA和DEA)的亞硝化,所述胺也存在于泡罩蓋箔上使用的油墨中。亞硝胺可以在熱封起泡過程中通過蒸發和冷凝轉移到產品中。Schlingemann及其同事證實了硝化纖維素基油墨(在帶狀包裝鋁箔上)在NDMA形成中的作用[37]。事實上,即使當片劑被密封在鋁條包裝內時,也會形成NDMA,鋁條包裝顯示出對硝酸纖維素、NO和NO2的優異阻隔性能。作者認為硝酸纖維素可能沉積在箔的內表面上,箔以圓柱形卷的形式提供。換句話說,硝酸纖維素可能已經滲透穿過玻璃紙層,并附著在通常與片劑接觸的內部低密度聚乙烯層上[37]。因此,基于硝化纖維素的蓋箔應該讓位于不含硝化纖維素的蓋箔。事實上,不含硝化纖維素的印刷油墨可商購獲得,在鋁箔和泡罩箔上具有優異的印刷性。然而,與其他因素相比,產生亞硝胺雜質的風險相對較低。
亞硝化反應抑制劑
當添加到固體劑量制劑中時,抑制劑可以通過充當氨基的競爭物來抑制亞硝胺的形成,氨基作為亞硝化劑的底物。例如,在一項研究中,這些抑制劑(抗壞血酸、抗壞血酸鈉、α-生育酚(維生素E)、咖啡酸、丁基化羥基甲苯、丁基化羥基茴香醚和阿魏酸)在含有仲胺藥物4-苯基哌啶鹽酸鹽(易形成亞硝胺)的制劑組合物中添加至1%濃度時,抑制亞硝胺生成超過80%[51]。據估計,在80%抑制下,在影響因素條件(50℃/75%RH,1個月)下,片劑中亞硝胺的量為7 ng,低于毒理學數據不足的N-亞硝胺毒理學關注閾值18 ng。抑制劑很可能通過氧化還原途徑(將亞硝化劑還原為非亞硝化一氧化氮)或通過硝化反應減少亞硝胺的形成。具有伯胺基團的氨基酸如甘氨酸、賴氨酸和組氨酸憑借其重氮化作用已顯示出作為液體劑型的潛在抑制劑的前景。
在溫和酸性條件下,抗氧化防腐劑BHA(丁基羥基茴香醚)被亞硝酸鹽轉化為硝基苯酚,阻止了NDMA的形成[52]。有人提出,硝基苯酚可能經歷代謝轉化并形成有毒物質,如羥胺衍生物。BHA和亞硝酸鹽之間的反應還導致另外八種化合物的形成,包括1-羥基-2-叔丁基-4-甲氧基-6-硝基苯[52]。最近的研究表明,硝基苯酚是一種非遺傳毒性雜質,可以設定更高的閾值限度。
亞硝胺雜質的監管策略
對于含有單一亞硝胺的藥品,FDA和EMA建議NDMA和NMBA的ADI不超過96 ng/天,NMBA的ADI不超過26.5 ng/天。NDEA、NMPA、NIPEA和NDIPA。這些限度假設患者每天暴露于藥物產品70年,癌癥風險為1:10 0,000。這些限度僅適用于制劑含有單一亞硝胺雜質的情況。FDA建議,如果藥品含有一種以上機構列出的亞硝胺雜質,且亞硝胺雜質總量基于最大日劑量不超過26.5 ng/天,則制造商應尋求FDA的指導。
對于MDD(最大日劑量)<880 mg/天的藥品,總亞硝胺限度為0.03 ppm(ppm=ADI(ng/天)/MDD(mg)),相當于不超過26.5 ng/天,被認為是可接受的[30]。另一方面,對于MDD大于880 mg/天的藥品,作為高劑量的風險緩解策略,需要調整亞硝胺的限量,以便不超過26.5 ng/天的推薦限量[30]。需要定量限低于0.03 ppm的分析方法來準確定量不超過26.5 ng/天的亞硝胺總水平[30]。然而,針對API開發的最靈敏分析方法的LOQ為0.005(5 ppb)。藥品中的LOQ可能要高得多。此外,由于最大日劑量超過1000mg,將需要靈敏度低于0.03 ppm的分析方法。
ADI不可用的亞硝胺的可接受攝入量可通過使用ICHM7(R1)指南[54-56]中提供的風險評估途徑來確定。指南中描述的毒理學關注閾值(TTC)方法使用最敏感物種和最敏感腫瘤誘導部位的TD50(中位毒性劑量)數據,將產生50%腫瘤發病率(TD50)的劑量外推至1/106發病率的簡單線性關系。對于大多數致突變污染物,1.5 μ g/天的TTC(相當于10-5的終生癌癥風險)被認為是可接受的。然而,黃曲霉毒素樣、N-亞硝基和烷基偶氮氧化合物已被確定為高效致突變致癌物為“關注隊列”(COC)。對于COC化合物,低于TTC的暴露甚至會導致顯著的癌癥風險,這表明它們需要控制在低得多的限度[56]。根據ICHM7,應進行化合物特異性風險評估以得出ADI值。
多博等人。根據共同的結構特征將N-亞硝胺雜質分為13組[57]。根據組中存在的最有效的N-亞硝胺將ADI分配到組中。13組ADI用于將ADI分配給結構相關的復雜N-亞硝胺雜質。他們將N,N-二烷基亞硝胺(NDMA、NDEA等。)放在第1組中,并根據NDEA公布的ADI值為26.5 ng/天。第7組(N-烷基-N-烷-2-酮型N-亞硝胺衍生物)和第9組(N-亞硝基哌啶衍生物)為分別分配了最低(17 ng/天)和最高(499 ng/天)ADI。有趣的是,在7個組中,至少存在一種亞硝胺,其TD50值≥1.5 mg/kg/天,對應于ICH M7(R1)中未歸類為COC的致突變雜質的可接受終生日攝入量1.5 μ g/天。在五組中,至少存在一種非致癌性N-亞硝胺,證實并非所有N-亞硝胺都是COC致癌物。根據作者的說法,復合N-亞硝胺的低致癌潛力可能是由于它們的空間和電子特性,這可能會阻止細胞色素介導的生物活化[57]。換句話說,α-碳的空間位阻和β-碳的吸電子基團與致癌效力的降低相關。亞硝胺原料藥相關雜質(NDSRIs)是另一類亞硝胺,據報道在生產或有效期儲存期間也會在某些藥品中形成。這類亞硝胺在結構上類似于API。最近,輝瑞公司召回了喹那普利/氫氯噻嗪(HCTZ),原因是其未能達到亞硝胺ADI限值,并召回了戒煙藥物伐尼克蘭的最新批次,因為存在高于ADI水平的可能致癌物N-亞硝基伐尼克蘭。FDA將N-亞硝基伐尼克蘭的可接受限度設定為37 ng/天[60]。2020年4月,所有雷尼替丁產品在美國被召回[11]。2020年9月,EMA建議在歐盟暫停所有雷尼替丁藥物[46]。該負面建議的主要原因是雷尼替丁本身在有效期內的降解導致了NDMA水平。Apotex Inc.生產的另一種含胺藥品阿昔洛韋片也因存在高于ADI水平的NDMA而被召回[61]。同樣,由于存在高于ADI水平的亞硝基奧芬那君雜質,Sandoz將13批枸櫞酸奧芬那君100 mg緩釋(ER)片劑召回至消費者水平[33]。FDA提出了多管齊下的控制策略,以將NDSRIs保持在可接受的水平以下,包括供應商資格認證計劃、抗氧化劑的使用以及通過使用碳酸鈉等賦形劑創造中性或堿性制劑微環境。
自2018年7月纈沙坦片劑中報告第一個亞硝胺雜質NDMA以來,超過每日ADI限值的亞硝胺的存在已導致超過1400種產品從美國市場召回/撤回。此后不久,在其他產品中檢測到亞硝胺,包括氯沙坦、厄貝沙坦、二甲雙胍和抗組胺藥(雷尼替丁和尼扎替丁),導致召回。此次召回是由于存在致癌亞硝胺雜質NDMA、NDEA和NMBA。NDMA和NDEA已被國際癌癥研究機構(IARC)、美國環境保護局(USEPA)和國家毒理學計劃(NTP)作為具有已知致癌潛力的物質,而NMBA已被證明可誘導大鼠膀胱癌和腎癌[63]。含沙坦的藥品被召回最多。此外,主要含有沙坦類藥物和其他API(如纈沙坦/HCTZ、氯沙坦/HCTZ、氨氯地平/纈沙坦、氨氯地平/纈沙坦/HCTZ和厄貝沙坦/HCTZ)的組合藥物產品也因ADI限值高于可接受閾值而被召回。
檢測了二甲雙胍原料藥(251份樣品)和二甲雙胍成品(875份樣品)是否存在亞硝胺雜質。在這些樣品中檢測到的唯一亞硝胺是NDMA。就二甲雙胍API而言,檢測的215個批次中有213個批次未顯示可測量的NMDA水平,而在成品中,17.8%的樣品(157個樣品)的NMDA高于ADI水平。這意味著82.2%的二甲雙胍藥品樣品符合質量和安全要求[64]。當分析來自患者的眾包二甲雙胍片劑的亞硝胺時,也獲得了類似的結果。大約16%的樣品的NMDA水平高于AI限值,在一個二甲雙胍500 mg片劑樣品中發現的最高NMDA水平為748 ng,約為ADI限值的31倍。在這項研究中,74%的樣本中檢測到DMF[65]。DMF具有與NDMA大致相同的分子量(74),除非使用具有合適靈敏度的分析方法,否則在二甲雙胍分析期間DMF可能與NDMA混淆,這可能導致人為的高結果。
結論
纈沙坦片中NDMA的存在將亞硝胺問題推到了風口浪尖。在沙坦類中發現的四唑環被認為是NDMA和其他短烷基鏈亞硝胺形成的原因。然而,它們很快也在非沙坦類產品中被檢測到,引起了對亞硝化劑形成機制和來源的擔憂。例如,在N-亞硝基伐尼克蘭的情況下,需要關注的是藥物相關雜質。亞硝胺或其前體可以存在于成品劑型的任何組分中。為了將其在藥品中的存在控制在ADI水平以下,一種有效的方法是評估所有制劑成分的風險,包括API、賦形劑、包裝材料和制造工藝。建議不要使用容易產生亞硝胺的成分。在沒有合適替代品的情況下,必須采取足夠的措施將亞硝胺維持在ADI水平以下。必須廣泛研究賦形劑生產途徑,以確定可能導致亞硝胺形成的可能賦形劑成分。為了理解輔料的硝酸鹽和亞硝酸鹽負載、輔料供應商和成品制劑制造商之間的有效溝通至關重要。制造商不得僅依賴原料藥和輔料的藥典規范,還應制定和實施額外的策略來控制亞硝胺雜質。避免使用基于硝化纖維素的蓋箔可以降低產品中亞硝胺雜質的風險。該制劑可以補充亞硝化抑制劑,如維生素C,以停止亞硝胺的產生。

來源:文亮頻道


