您當前的位置:檢測資訊 > 行業研究
嘉峪檢測網 2024-12-30 09:03
摘要 目的:總結、分析藥品進口備案工作現狀,探索我國現行藥品進口備案制度微調趨勢,為今后政策制定和優化革新提供參考。方法:運用文獻查詢、數據統計和綜合分析的方法,梳理藥品進口備案中存在的問題,找出各類問題的主要成因及其管理現狀。研究近年來我國關于藥品進口備案相關文件公告的政策趨勢。結果:針對存在問題提出解決方法,施行新方法后藥品進口備案現狀有效改善。結論:提高對藥品進口備案相關法規和政策文件的認識,將其合理運用在實際工作中。建議依國際發展趨勢彈性調整藥品進口備案執行層面的審查規則,以保證企業合規申報,同時提高進口藥品通關效率。
2019年11月,北京、上海、廣州3個口岸所在地藥品監督管理部門率先啟用海關“中國國際貿易單一窗口”(以下簡稱“單一窗口”)審批平臺,企業無需跑動便可隨時隨地網上申請、網上查詢辦理結果,切實貫徹落實《國務院關于印發優化口岸營商環境促進跨境貿易便利化工作方案的通知》(國發[2018]37號)[1]文件精神。自此,我國藥品進口備案工作開啟了全新的模式。
《藥品進口管理辦法》( 以下簡稱“ 辦法”)[2]規定,“進口藥品通關單”是進口藥品海關通關放行的入境憑證。藥品進口備案(以下簡稱“備案”)既是進口藥品監管的起點,也是后續監管溯源的源頭。新模式下產生了如何保證上傳資料完整性和準確性及現場核驗原件的可操作性的新問題,給“備案”工作帶來了困擾,如何既保證企業合規申請又提高通關效率成為“備案”工作的焦點。目前各口岸對新問題的處理尚無統一做法。
為此,筆者從近3年辦理“備案”告知補正(當行政機關認為申請材料不齊全或者不符合法定形式時,對申請人的告知行為)的數量變化為切入點,對各類通關痛點進行細化分類、歸納和總結,針對分類數據成因、現行處理方式做出較為詳盡的闡述和剖析并對各類問題提出了解決方案。
1 進口備案告知補正的總體概況
1.1 數據來源與分類
本文分析的數據來源于2021-2023年度單一窗口備案平臺4000余份告知補正的“備案”資料,對告知補正內容按照報驗單填報、資料上傳、現場核驗原件這3個環節進行數據整理和分類統計。
1.2 告知補正總體情況
3年來,“備案”告知補正比例依次為52%、45%和31%,根據3個環節在年度的占比情況進行橫向對比,報驗單填寫情況逐漸改善,上傳資料、現場驗證環節問題略有升高(見圖1)。
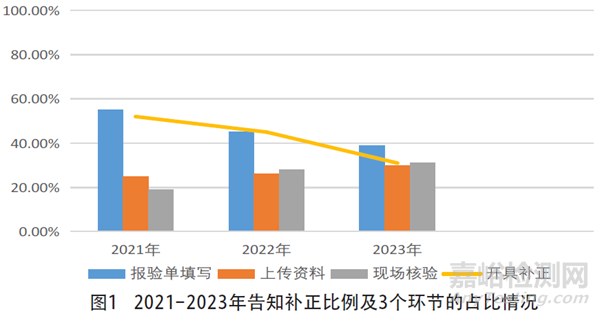
1.3 各環節具體問題
1.3.1 報驗單填報
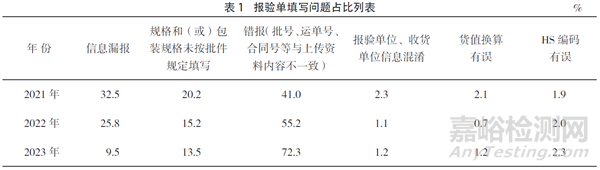
在單一窗口申報中,最常見的是信息填報錯誤,主要包括:信息漏報;規格和(或)包裝規格未按批件規定填寫;批號、運單號、合同號等與上傳資料內容不一致;報驗單位、收貨單位相關信息混淆;貨值換算有誤和協調制度(HS)編碼有誤(見表1)。
1.3.2 資料上傳
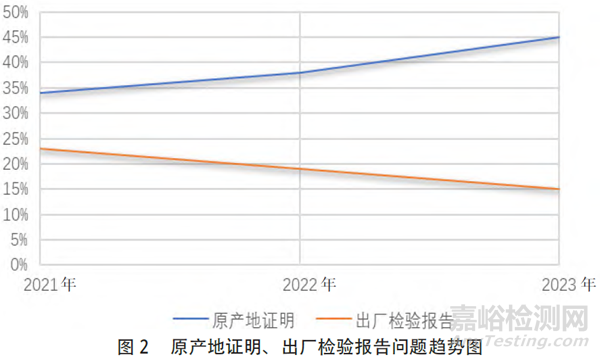
企業通過單一窗口填報基本信息后,需上傳隨附資料,其中,原產地證明(Certificate Of Origin,COO)、出廠檢驗報告(Certificate OfAnalysis,COA)、貿易資料/質量標準和說明書、包裝標簽發生問題居多,又以原產地證明和出廠檢驗報告資料出現問題更為突出,兩項約占總問題的55%(具體見圖2)。
1.3.3 現場核驗
隨著藥品監管電子證照的推廣,辦理“備案”所需注冊證明性文件呈現電子化、多樣化的局面。新舊兩種形式的批準文件、國家藥品監督管理局授權的區域化證明性文件及國家藥品監督管理局數據平臺的備案信息等均可以作為申報的證明文件或數據變更的參考依據。面對形式多樣的證明性文件,現場核驗常見以下問題:1)注冊證明文件不完整、上傳的復印件與原件不一致;2)原產地證明原件缺失或載明信息與上傳資料不一致。
2、 不同環節問題的成因分析
問題不同,映射出的本質也不盡相同。3個環節的問題既孤立存在又常常相互聯系。以下針對各環節主要問題逐一展開分析。
2.1 報驗單填報常見問題分析
1)漏報:使用單一窗口早期,漏報信息主要由于從單機版向全面電子化申報轉型的過渡階段,報驗單位對填報規則缺乏認識,如原料藥憑登記平臺的備案登記號進口,企業申報時找不到填寫路徑,誤填為企業營業執照編號或《藥品經營許可證》編號;2)錯報:當報驗單位同時到港多批貨物,一次性申請多個“進口藥品通關單”時,批號、運單號、合同號等信息混淆致使填報錯漏;
3)報驗單位、收貨單位相關信息填寫有誤:此類問題多見于首次申報的異地企業。由于需要法定檢驗,口岸藥檢所需在存貨地址進行抽樣,異地報驗單位往往會委托當地具有藥品存放資質的藥品經營企業代為收貨、倉儲和協助抽檢工作。此時收貨單位的業務范疇已延伸至倉儲環節,而報驗單位未將收貨單位倉庫地址填寫在存貨地址一欄;4)HS編碼填寫有誤:多見于海關每年對HS編碼進行部分調整的時間段。
2.2 資料上傳常見問題分析
1)COO問題:①COO非原產國出具:近3年,憑“進口藥品批件”進口的藥品1105批次,一部分用途為仿制藥研究對照品,另一部分屬于粵港澳大灣區內地臨床急需藥品。兩種一次性進口藥品均有較大的需求量:仿制藥研究一次性進口的申報量雖較2018年高峰期已明顯減少,但每年的申報量也仍有200余份;粵港澳大灣區內地臨床急需藥品是根據2021年8月25日《廣東省粵港澳大灣區內地臨床急需進口港澳藥品醫療器械管理暫行規定》(下稱“暫行規定”)[3],由廣東省藥品監督管理局簽發《粵港澳大灣區內地臨床急需進口港澳藥品批件》,此類藥品申報逐年增加,其屬于臨床急需,通關效率與患者生命健康密切相關。上述兩類情況,由于產品未在我國上市,進口頻次低,數量少,很難直接從生產廠或藥品上市許可持有人(Marketing Authorization Holder,MAH)直接購入,多數經中間商購買,因此,無法按《藥品進口備案工作指南》(以下簡稱“工作指南”)審查規定提供由原產國出具的COO。②COO載明藥品與《中華人民共和國藥典》(以下簡稱《中國藥典》)不一致:進口藥材申報時常出現COO載明的藥材名稱與申報不一致。主要由于企業申報時對《中國藥典》和《進口藥材管理辦法》知之甚少,同時與出口商缺乏有效溝通。
2)COA問題:① COA的產品批號與申報不一致最為常見,問題的產生源于歐盟1965年頒布的Directive65/65/EEC及現行的Directive2001/83/EC 仍沿用的MAH的定義及其權責義務[4]。其中規定MAH可委托不同國家的生產廠進行生產、包裝并委托第三方機構出具[5]放行記錄,同時對藥品質量進行監督和履責。由于其生產、包裝、放行涉及多個國家,呈現高度國際化、錯綜復雜的委托關系,每個環節均可能生成新的批號,因此,企業僅上傳COA大概率會出現批號與申報不一致的情況;②成品放行日期晚于發貨日期情況偶有發生,多由于GMP體系中特殊的放行規則所致。
3)貿易資料/質量標準、說明書、包裝標簽的漏傳、轉口貿易資料不完整等多由于企業對于法規缺乏了解、疏于對藥品報驗人員進行系統的知識培訓導致上傳資料與填報信息不匹配、不合理。
2.3 現場核驗問題分析
按照《中華人民共和國藥品管理法實施條例》[6]第37條,領取《進口藥品通關單》需要核驗注冊證明文件及COO原件。
1)注冊證明文件: ①證明文件提供不完整:2022年10月9日《國家藥監局關于發放藥品電子注冊證的公告》[7]頒布后,紙質與電子版注冊證明文件處于有效并行的過渡階段,兩種形式的文件內容往往不能相互覆蓋,現場核驗需要同時提供兩種形式的文件,遺漏已授權的電子證照或未提供紙質文件的情況時有發生;②證明文件提供與申報不一致:由于各類注冊證明文件均由國家藥品監督管理局通過“申請人之窗”或“法人空間”下發至主送單位的賬戶,報驗單位和主送單位掌握信息不對稱。現場核驗時才發現注冊證明文件已經變更,而報驗單位仍使用舊的證明文件進行申報,從而導致核驗失敗。
2)COO:①無法提供簽字版COO:隨著世界范圍各領域電子化文檔的廣泛使用,越來越多的商會已將COO納入電子文件的管理范疇。出口商不再出具簽字版COO,而由企業在系統自行打印。此類COO不符合“工作指南”的審查規定。②原件內容與上傳件不一致:主要是原產地證編號和簽名與上傳件不一致。這些問題的產生多見于a.商會一次性出具多個正副本,產生不同編號,外商掃描給企業的文件與寄出的原件并非同一份資料;b.部分商會簽發的COO需由COO申請人蓋章簽名后方可生效,但企業急于申報,僅上傳商會蓋章版的COO,待收到COO原件后才發現兩者不一致。
3、 措施與結果
正視“備案”存在的問題并客觀分析成因,是解決企業合規申請、通關提速的第一步。究其根本才是對癥治療的良方,基于目前存在的問題可將其分為“軟傷”和“硬傷”分類解決。
“軟傷”是指:本質上可以回避,通過糾正進行改變和提高。報驗單信息填報錯誤、漏傳、錯傳資料及COO內容與報驗不一致等問題均可以歸為“軟傷”。廣州市口岸藥監局加強服務意識,提出“靠前服務”,建立“首次咨詢負責制度”和科學的培訓管理體系,為企業普及藥品進口備案知識、政策法規,提高業務人員的法律意識、質量意識、風險意識和責任意識。同時,加強工作人員業務學習,提高口岸工作人員對各類問題的處理能力,從而提高通關效率。
“硬傷”是指:本質上無法回避,或很難解決的問題。上傳資料中COO和COA問題、核驗原件中的部分問題可歸為“硬傷”。這些問題的產生是由于現有法規對藥品進口的實際情況尚未完全涵蓋[8]所致。通過深度挖掘政策沿革的趨勢,尋找和探索“備案”執行層面彈性操作的依據。國家食品藥品監督管理總局分別在2016年7月1日簽發的《總局關于研制過程中所需研究用對照藥品一次性進口有關事宜的公告》(2016年第120號)[9]、《國家藥監局關于臨床試驗用生物制品參照藥品一次性進口有關事宜的公告》(2018年第94號)[10]和《國家藥監局關于生物類似藥臨床研究用原研參照藥進口有關事宜的公告》[11](2019年 第44號),連續3次對一次性進口藥品的品種范圍進行擴增,放寬了一次性進口時對原研藥品產地的限制。這些政策都是為進一步落實《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》[12]的要求,深入推進“放管服”改革,為促進藥品創新和仿制藥發展做出的審批制度的改革。政策微調后較之以往對原研藥品原產地的嚴格限制略有放寬,釋放了制度革新的信號。廣東省藥品監督管理局結合《廣東省粵港澳大灣區內地臨床急需進口港澳藥品醫療器械管理暫行規定》的文件精神,于2023年1月出臺《廣東省藥品監督管理局關于優化藥品進口備案工作的指導意見》[13],對部分通關備案政策進行優化,為探索政策微調下的“備案”工作指明方向。
通過提高服務意識以政策微調、優化為指引,廣州口岸2023年告知補正明顯降低,顯著提高了臨床急需藥品的通關效率,滿足了患者急需用藥的訴求。
4、 討論
政策微調是適應世界發展大趨勢,是推進法規日臻完善的必經之路。筆者對 “硬傷”的解決對策有如下思考:
4.1 COO在資料上傳和審查環節的處理
①我國自2004年《藥品進口管理辦法》頒布至今,COO是唯一用以證明進口貨物真實產地的證明性文件,“工作指南”對其審查要點有詳細的規定。它是保證進口藥品來源于原產地的重要佐證資料,也是進口藥品質量保障的文件依據。在MAH制度較為成熟、完善的歐盟、美國和日本等地,MAH對藥品的安全性、有效性和質量管理控制進行全面負責[14],2019年《中華人民共和國藥品管理法》對MAH權責的解釋,進一步強調并規定了MAH在藥品全生命周期的重要性[15]。因此,基于對MAH在整個藥品質量體系中的角色認同,建議在一定范圍內放寬對COO開具地的限制,對研發用仿制藥一次性進口及臨床急需藥品,可由MAH所在國按《藥品進口備案指南》的規定出具COO,視作與原產國同等效力的COO。除此以外,申請類別為進口藥品報驗、注冊用藥品用途為注冊檢驗的均應嚴格執行“辦法”的規定,保證進口藥品溯源的準確性和唯一性。
②核驗COO原件是對其真實性、有效性的進一步確認。由于電子證照在世界范圍內的推廣,紙質原件的核驗變得越來越困難。建議對COO原件核驗區分處理:a.商會出具紙質版的,仍按照規定提供紙質版COO;b.采用電子COO的,單一窗口上傳商會公告和COO,并在審核環節根據COO載明的網址及安全碼查驗真實性,現場驗證時可提供打印件,與系統資料核對。
4.2 COA資料上傳的分類處理
① COA批號與申報不一致:企業應提供COA但不限于該報告,建議悉數提供可供溯源的相關資料,直至追蹤至與申報一致的批號,確保批號的可溯源及真實性。
② COA由MAH委托第三方出具的,建議可提供經國家藥品監督管理局藥品審評中心審核通過的注冊申請資料中涉及生產廠、包裝廠和放行廠的相關資料作為審核依據,保證出具企業的有效性和真實性。
③日常工作中也偶有無菌藥品出廠檢驗報告簽發晚于發運時間的情況。2007年國家食品藥品監督管理局下發了《關于繼續開展藥品參數放行試點工作的通知》[16],全球GMP體系高度耦合,如何認識參數放行、如何判斷各環節時間節點對口岸工作人員也是新的挑戰。
4.3 注冊證明文件原件核驗的分類處理
① 核驗紙質文件:驗證前,口岸工作人員應協助報驗企業與上市申請人進行有效溝通,保證提供的資料完整、可溯源。對于已發放《藥品補充申請批準通知書》的,應及時申報,并在規定時間內對相關文件進行修訂、替換,從而確保現場核驗時提供完整、有效的資料。
②電子證照:采用電子證照的應由上市申請人授權委托使用單位,并在國家藥品監督管理局網上辦事系統進行核驗。由于國家藥品監督管理局電子證照應用場景和使用方式[17]中部分功能尚未實現,電子驗證操作沒有數據留痕。建議在中國藥監APP平臺,通過網絡管理技術授權各口岸工作人員核驗權限,實現電子證照應用場景的全部功能,保證亮碼與掃碼的有效性。
綜上所述,20年來,“辦法”為進口藥品監管筑起了第一道堡壘,為保證進口藥品質量起到了至關重要的作用。然而,隨著時代的發展,“辦法”使得執行層面遇到一些困惑,影響了通關效率。因此,政策微調勢在必行,它將是一次具有活力和創新的制度改革,是“備案”執行標準調整的唯一法規依據,更是新形勢下持續堅守進口藥品國門第一關更全面的制度保障。
參考文獻
[1] 中華人民共和國國務院. 國務院關于印發優化口岸營商環境促進跨境貿易便利化工作方案的通知(國發[2018]37號)[EB/OL].(2018-10-13)[2023-10-06]. https: //www. gov.cn/gongbao/content/2018/content_5335363.htm.
[2] 國家市場監督管理總局. 藥品進口管理辦法[EB/OL].(2004-01-01)[ 2023-10-06]. https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/bgt/art/2023/art_7dde931fd2f43b 699a0edc5d4ca9.html.
[3] 廣東省藥品監督管理局. 廣東省粵港澳大灣區內地臨床急需進口港澳藥品醫療器械管理暫行規定[EB/OL].(2021-08-25)[2023-10-06]. https://mpa.gd.gov.cn/xwdt/tzgg/content/post_3498383.html.
[4] European Medicines Agency. Marketing Autherisation.[EB/OL].(2019-05-01)[2023-10-06]. https://www.ema.europa.eu/en/human-regulatory/marketing- authorisation.
[5] 國家藥品監督管理局. 藥品管理法疫苗管理法讀本[M].北京:法律出版社,2021:65-67.
[ 6 ] 國家藥品監督管理局. 中華人民共和國藥品管理法實施條例[ E B / O L ] . ( 2 0 1 9 - 0 3 - 0 2 ) [ 2 0 2 3 - 1 0 -06]. https://www.nmpa.gov.cn/xxgk/fgwj/ fl xzhfg/20230328161255114.html.
[7] 國家藥品監督管理局. 國家藥監局關于發放藥品電子注冊證的公告(2022年 第83號)[EB/OL].(2022-10-09)[2023-10-06]. https://www.nmpa.gov.cn/ xxgk/ ggtg/ypggtg/ypqtggtg/20221009195621184.html.
[8] 王鵬峰,田麗娟. 我國現行藥品進口備案制度分析[J].中國食品藥品監管,2023(2):70-75.
[9] 國家食品藥品監督管理總局. 總局關于研制過程中所需研究用對照藥品一次性進口有關事宜的公告(2016年第120號)[EB/OL].(2016-06-23)[2023-10-06]. https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20160701164301806.html.
[10] 國家藥品監督管理局. 國家藥監局關于臨床試驗用生物制品參照藥品一次性進口有關事宜的公告(2018年第94號)[EB/OL].(2018-11-30)[2023-10-06].https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20181130172201970.html.
[ 1 1 ] 國家藥品監督管理局. 國家藥監局關于生物類似藥臨床研究用原研參照藥進口有關事宜的公告(2019年第44號)[EB/OL].(2019-05-27)[2023-10-06]. https://www.nmpa.gov.cn/ xxgk/ggtg/ypggtg/ypqtggtg/20190528171701827.html.
[12] 中華人民共和國國務院. 關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見(2017年第29號)[EB/OL].(2017-10-08)[2023-10-06]. https:// www.gov.cn/gongbao /content/2017/content_5232362.htm.
[13] 廣東省藥品監督管理局. 廣東省藥品監督管理局關于優化藥品進口備案工作的指導意見[EB/OL].(2023-01-10)[2023-10-06]. https://mpa.gd.gov.cn /zwgk/gzwj/content/post_4097687.html.
[14] 朱佳嫻,施綠燕,顓孫燕,等. 歐盟、美國、日本藥品上市許可持有人制度分析及啟示[J].上海醫藥,2020,41(1):47-51.
[15] 國家藥品監督管理局. 國家藥監局綜合司公開征求《境外藥品上市許可持有人境內代理人管理暫行規定(征求意見稿)》意見[EB/OL].(2020-7-31)[2023-10-6]. https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/2020080319064 5124.html.
[16] 國家食品藥品監督管理局. 關于繼續進行參數放行試點工作的通知(國食藥監安(2007)419號)[EB/OL].(2007-07-09)[2023-10-06]. https://www.nmpa.gov.cn/xxgk / fgwj/gzwj/gzwjzh / 20070709010101400.html.
[17] 國家藥品監督管理局. 國家藥監局電子證照你問我答[EB/OL].(2022-11-11)[2023-10-06]. https://www.nmpa.gov.cn/xxgk/zhcjd/tjzhc/tjzhczh/20221111163057192.html.

內容來源:中國藥事 2024 年12 月 第38 卷

來源:Internet


