摘要
藥品中微量水平的遺傳毒性物質具有引發腫瘤甚至癌癥的風險,并且該致癌風險可能與劑量沒有相關性。因此,目前各國監管機構要求對藥品中遺傳毒性雜質進行嚴格控制。本綜述通過查閱國內外相關文獻、指導原則,從監管機構對藥品中遺傳毒性雜質的監管策略、遺傳毒性雜質來源、檢測方法及清除策略4個方面進行了系統的總結綜述。該綜述為藥品中遺傳毒性雜質的控制/清除、檢測提供了參考和依據。
關鍵詞
遺傳毒性雜質;來源;檢測方法;清除
通常,藥品中的活性成分可以通過全合成或者以天然產物為先導化合物,進行結構修飾以獲得。而上述這兩種情況,均需要使用多種化學試劑并經過一步或多步化學反應。因此,即使經過純化步驟,在最終的原料或制劑中,還會存在一定量的和藥效無關的雜質。同時,在藥品的制劑或儲存過程中,也可能生成一定量的雜質。
這些雜質和藥效無關,同時可能具有毒性,甚至具有遺傳毒性和致癌性。美國食品藥品監督管理局(Food and Drug Administration, FDA)、歐洲藥品管理局(European Medicines Agency,EMA)等各國藥品監管機構自2006年已開始持續關注原料藥中遺傳毒性雜質的情況,及可能對人體健康造成的負面影響。
遺傳毒性雜質是指能夠直接或間接損傷細胞DNA,造成DNA突變并伴有致癌性危害人類健康的物質。其對DNA的損害包括染色體斷裂、DNA重組及復制過程中共價鍵的插入和修飾,也包括在細胞水平上產生遺傳毒性物質而造成的突變。由于微量水平的遺傳毒性物質也會對服藥者造成不可逆轉的危害,可能會引發腫瘤甚至癌癥的風險,并且該致癌風險可能與劑量沒有相關性,存在遺傳毒性化合物在極低劑量水平下導致人體DNA損傷,且該損傷效應可通過遺傳物質的復制而不斷放大的風險。因此對遺傳毒性雜質的檢測和控制極其重要。
遺傳毒性雜質的種類較多,有黃曲霉素類、亞硝胺化合物、烷基-氧化偶氮基化合物,磺酸酯類、氯代烷烴類、苯胺類、硝基苯、多環芳烴以及疊氮化物等。由于黃曲霉素類、亞硝基化合物、烷基-氧化偶氮基化合物毒性較強,屬于特殊關注隊列(表1)。
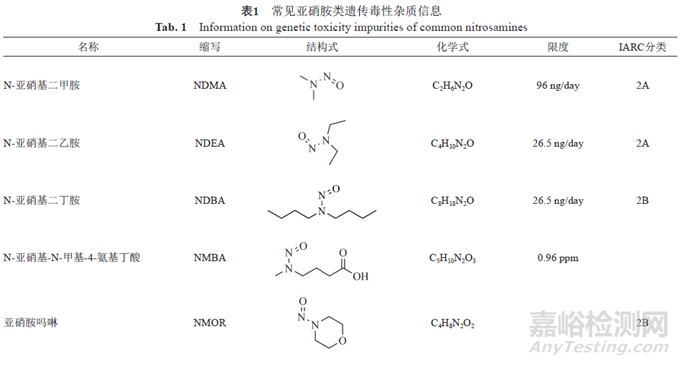
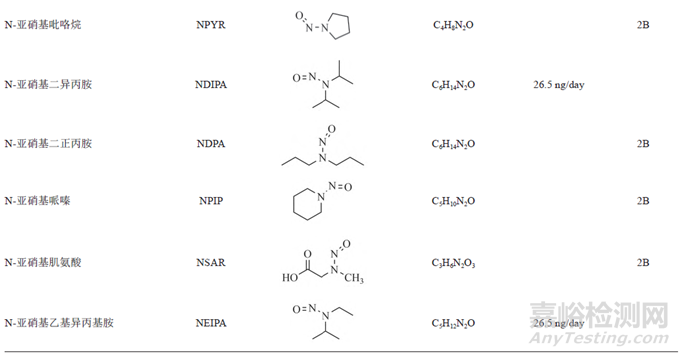
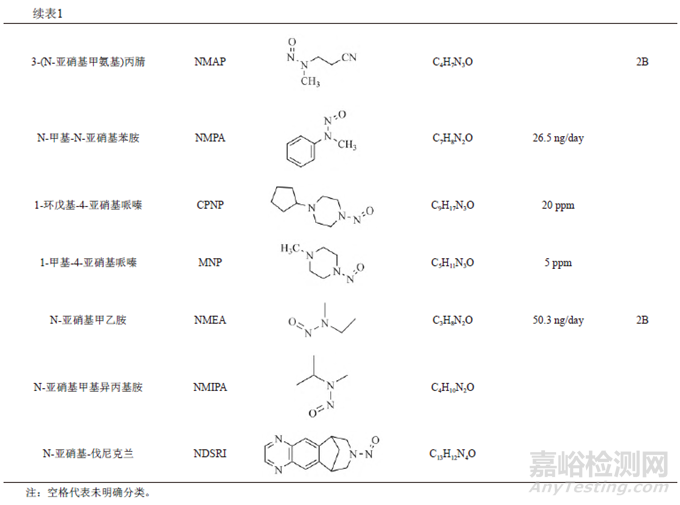
近年來,亞硝胺化合物殘留而引發藥品召回的事件頻發。2018年,浙江省華海藥業在纈沙坦原料藥中檢測出微量的亞硝胺類遺傳毒性雜質N-亞硝基二甲胺(N-nitrosodimethylamine,NDMA)后,亞硝胺類雜質事件引起了業內的普遍關注。2019年3月,FDA公布氯沙坦鉀片中亞硝胺類遺傳毒性雜質N-亞硝基-N-甲基-4-氨基丁酸(N-Nitroso-Nmethyl-4-aminobutyric acid,NMBA)超出暫定控制限度(0.96ppm)。同年9月,FDA發布安全警告,雷尼替丁中檢出亞硝胺類遺傳毒性雜質NDMA,之后也導致相關產品被召回。隨后FDA又在降糖藥二甲雙胍中檢出微量NDMA。2020年7月,WHO公布在賽諾菲公司的利福平、利福噴丁中檢出亞硝胺雜質MNP、1-環戊基-4-亞硝基哌嗪(1-cyclopentyl-4-nitrosopiperazine,CPNP),隨后FDA也公布了其暫定限度為5和20ppm。2021年,因含有亞硝胺化合物N亞硝基-伐尼克蘭,輝瑞公司召回戒煙藥Chantix。次年又因亞硝胺類雜質超標,長效降壓藥鹽酸普萘洛爾被召回。上述事件總結見圖1。此類亞硝胺雜質事件頻發,增加了患者使用藥物的風險,也給企業帶來了無法估計的損失,同時也給制藥行業和監管機構敲響了警鐘。
本綜述希望通過對藥品中亞硝胺類雜質的來源、檢測方法、控制策略和清除的方法進行探討,為相關人員提供參考。
1、亞硝胺類遺傳毒性雜質的監管
20世紀以前,對于藥品中遺傳毒性雜質的監管的制度和措施幾乎空白。隨著檢測技術和監管理念的發展,近年來,各個國家和地區的藥物監管措施的逐漸完善。
2002年,EMA的專利藥物委員會(Committee for Proprietary Medicinal Products,CPMP)后更名為人用藥物委員會(Committee for Human Medicinal Products,CHMP)發布關于遺傳毒性雜質的意見書。該意見書按照雜質是否存在有證據的閾值而將遺傳毒性雜質進行分類:①有足夠的研究證據支持其閾值的雜質,建議參照ICH Q3C中二類溶劑的方法進行控制;②無充分閾值研究證據的雜質,采用“最低技術可行”(as low as technically feasible,ALATF)的原則進行控制。
2004年,EMA發布遺傳毒性雜質限度指南(草案),對意見書進行了修改。默認完全消除遺傳毒性雜質的引入風險是無法實現的,改以“最低合理可行”原則(as low as reasonably practical,ALARP)替代了“最低技術可行”(ALATF)原則,建議用毒理學關注閾值(threshold of toxicological concern,TTC)作為遺傳毒性雜質的可接受限度。TTC根據半數致癌劑量(median toxic dose,TD50)的五萬分之一為攝入量進行線性外推,從而得到十萬分之一(10-5)致癌率的攝入量,并以此數值作為每人每天最高攝入量。上述TD50的數據通常來源于致癌性強度數據庫(carcinogenicity potency database,CPDB)以及嚙齒類動物致癌性試驗數據庫。
由于部分遺傳毒性雜質致癌性強,危害較大,即使低于“毒理學關注閾值”也會對人體有較大致癌風險,所以美國藥品研究與制造企業協會(Pharmaceutical Research and Manufacturers of America,PhRMA)又提出了“五分類”系統,將遺傳毒性雜質分為5類。2014年,人用藥品注冊技術協調會(the international council for harmonisation of technical requirements for pharmaceuticals for human use,ICH)在EMA、PhRMA和FDA的基礎上頒布了關于遺傳毒性雜質指南ICH M7,對“五分類”做了一些增補,見表2。
2017年,ICH評估和控制藥物中DNA反應性(致突變)雜質的ICH M7指導原則將致癌風險高的N-亞硝基類化合物列為“特殊關注隊列”,并根據其致癌性相關分析,將其列為“具有已知致癌致突變性”的Ⅰ類雜質。
根據ICH M7和EMA相關指南,作為“特殊隊列”中的亞硝胺類雜質應根據藥物每日最高使用劑量計算終身使用的藥物中亞硝胺類雜質的臨時限度。也可根據TD50等其毒理學參數計算每日允許暴露量(permitted daily exposure,PDE)或每日允許攝入量(acceptable daily intake,ADI)。然后在此基礎上,根據每日用藥量和用藥周期對其限度進行確定。若在CPDB及嚙齒類動物致癌性試驗數據庫中未查見亞硝胺雜質的TD50值,可以采用相似結構化合物的TD50值計算雜質限度。
當然,存在著一種藥物中含有多種遺傳毒性雜質的風險。EMA安全工作小組(safety working party,SWP)對于含有兩種及以上的亞硝胺類雜質的限度控制,提出了兩種監管策略:第一種策略是按照致癌風險最強的一種亞硝胺雜質的限度進行控制;另一種策略將總含量控制在罹患腫瘤的風險不超過10-5的水平。同時,SWP提供一種替代方法,建議為每種亞硝胺雜質設定一個特定的限值,從而確保所有檢出的亞硝胺雜質的總和不超過10-5的總風險水平。而對于毒理學數據不足的亞硝胺類雜質的控制限度,比如N-亞硝基甲乙胺(N-nitroso-methylethylamine,NMEA)、N-亞硝基二丙胺(N-nitrosodi-N-propylamine,NDPA)胺類化合物,EMA推薦使用結構上與其最為接近的亞硝胺類化合物的TD50為基礎估算其限度。而對于短期服用藥物,ICH M7提出了可使用小于壽命(less than lifetime,LTL)的方法計算其限度。但是,當前多數CHMP專家基于亞硝胺類雜質暴露量與DNA損傷無嚴格線性關系,同時經過LTL計算后,限度偏高,造成短期風險增大。
我國對于遺傳毒性雜質的研究起步較晚,2017年我國加入ICH后,相繼頒布了指導原則。2019年1月,國家藥典委員會發布關于遺傳毒性雜質指導原則審核稿,指導遺傳毒性雜質的分類和控制,《中國藥典》2020版四部通則中新增了該指導原則。2020年5月,我國國家藥品監督管理局藥品藥審中心網站發布了《化學藥物中亞硝胺類雜質研究技術指導原則(試行)》,該原則對準備注冊申請上市和已上市化學藥品中亞硝胺類雜質的研究和控制提供了指導原則。
2、亞硝胺類傳毒性雜質的來源
藥品中亞硝胺類遺傳毒性雜質的產生的原因復雜且多樣。從產生機理角度分析,亞硝胺類遺傳毒性雜質的產生機理分為兩大類:一是經典的亞硝化反應。如不同胺類化合物與不同亞硝化試劑相互作用發生的亞硝化反應,主要以仲胺和叔胺化合物為主,亞硝化試劑主要包括亞硝酸根離子、亞硝酰鹵化物、亞硝酸酯、三氧化二氮和四氧化二氮等。二是非經典類的亞硝化反應。硝基胺高溫下的還原反應,硝基胍用鋅粉還原可形成亞硝胺;肼類化合物如偏二甲肼發生的氧化反應;還有腙臭氧分解成亞硝胺;有機金屬的亞硝化;將格氏試劑加入到一氧化氮中可以得到亞硝基羥胺等。其中常見的反應就是亞硝化反應,任何含N-H的化合物都可能發生亞硝化反應,比如胺、(雜)酰胺、氨基甲酸酯、羥胺、羥胺醚、肼、腙、酰肼、脲和胍。上述反應機理如圖2所示。
藥物在生產、儲藏的過程中均有可能產生亞硝胺類雜質。華海藥業在纈沙坦的合成路線中使用了疊氮化鈉,其溶劑為N, N-二甲基甲酰胺(N, Ndimethylformamide,DMF)。該合成路線相對于之前的合成路線,具有收率高的特點。但經研究表明,溶劑DMF在合成過程中,會降解生成二甲胺。二甲胺會與淬滅過量的疊氮化鈉使用的亞硝酸鈉發生亞硝化反應,進而產生亞硝胺類雜質NDMA。強效組胺H2受體拮抗劑雷尼替丁本身結構中的硝基和二甲胺發生也會亞硝化反應,降解產生NDMA。與雷尼替丁結構相似,二甲雙胍結構中也含有一個二甲胺,容易與亞硝酸鹽生成亞硝胺雜質。
基于以上機理,亞硝胺類遺傳毒性雜質來源主要有3種途徑:一是來源于生產工藝。在生產過程中引入了胺類化合物或亞硝化試劑,如起始原料、反應物、中間體以及藥物合成中發生的副反應。此外還應考慮某些溶劑、催化劑等也會降解生成仲胺或叔胺化合物。沙坦類中NDMA的來源就是生產工藝使用了胺類和亞硝酸鈉反應產生的。并且生產過程使用的溶劑DMF和N-甲基吡咯烷酮的水解或者熱降解分別產生仲胺如二甲胺和甲基丁胺,隨后發生N-亞硝化反應,最終產生NDMA和NMBA;二是可能來源于儲存過程、包裝材料以及并線生產等。含有硝化纖維的泡罩包裝也會生成亞硝胺雜質;三是來源于起始物、中間體或原料的降解產物。比如雷尼替丁中的NDMA雜質是在儲存過程中降解產生的,尤其高溫加熱時生成的亞硝胺雜質更多。
遺傳毒性雜質具有重大的遺傳毒性風險,是需要重點控制的雜質,對遺傳毒性雜質控制的水平可以反映藥品質量標準的水平。因此為了人類的健康和安全,有必要了解其產生機理并建立一種靈敏的方法來檢測和定量藥品和藥品中的遺傳毒性雜質。同時對雜質的清除措施也需十分明確。
3、亞硝胺類遺傳毒性雜質的清除
2020年6月,EMA就上市許可持有人如何避免在人用藥中產生亞硝胺類雜質提出指導意見:調整生產工藝,提前預防亞硝胺化合物的生成;做好合成路線、起始原料、中間體、原料(溶劑、試劑、催化劑等)的風險評估,找出生成亞硝胺化合物的潛在原因;如若通過實驗證實確有亞硝胺化合物存在,應考慮改變生產工藝、原料和中間體、原材料或初級包裝(如含有硝化纖維的泡罩包裝等),以避免使用亞硝化劑;如果證明亞硝化劑與溶劑、試劑和催化劑的結合在整個過程中不可避免,則應在原料藥和制劑生產中實施適當的控制措施。
FDA在21世紀提出“質量源于設計”(quailty by design,QbD)理念,其被定義為基于一種科學和質量風險管理之上,預先定義好目標產品質量并強調對產品與工藝的理解及控制的一個系統的研發方法。對潛在遺傳毒性雜質進行風險評估的策略就是利用質量源于設計提供更詳盡的對工藝的理解,最終確定雜質產生的臨界區域。Madasu等采用上述策略,設計了氯沙坦鉀鹽的5步合成法。從設計源頭避免并控制雜質的產生,才是控制雜質產生的根本途徑。藥品在設計生產時,如避免不了雜質的產生,也應盡量控制雜質在最終反應4步以外產生,再設立雜質清除步驟。
4、亞硝胺類遺傳毒性雜質分析方法研究進展
由于亞硝胺類遺傳毒性雜質在極低的濃度就具有較強的毒性,同時該類雜質具有低分子量、高親水性的特點,是檢測的難點。目前關于藥物中亞硝胺類雜質的檢測方法,主要包括如高效液相色譜-紫外檢測器(HPLC-UV)、高效液相色譜-質譜(HPLC-MS)、氣相色譜-質譜(gas chromatography-mass spectrometry,GC-MS)等。
4.1 高效液相色譜法
高效液相色譜法是藥物分析中最為普遍的方法,其具有靈敏度高,專屬性好的優點。70%以上的化合物都可以用高效液相色譜分離。由于亞硝胺類遺傳毒性雜質的高親水性,十八烷基硅烷(octadecylsilyl,ODS)或苯基硅烷鍵合相色譜柱常用于亞硝胺類雜質的分離。常使用的檢測器包括紫外檢測器、質譜檢測器和熒光檢測器等。
4.1.1 紫外檢測器
由于其簡便性和可及性,帶紫外的液相色譜可應用于較高濃度的遺傳毒性雜質測定的快速篩查和定量。Sayaka-M等采用Inertsil ODS-3柱(150mm×4.6mm,5μm,GL Science)建立了高效液相色譜-光電二極管陣列檢測器(photo-diode array detector,PDAD)檢測纈沙坦中NDMA的定量方法。該方法檢測限為0.057~0.17ppm,定量限為0.19~0.57ppm。上述方法可用于纈沙坦原料藥和市售產品中NDMA雜質的快速篩查和定量。Kunjan等采用C18(250mm×4.6mm, 5μm)色譜柱建立了HPLC-UV同時測定纈沙坦中6種亞硝胺雜質的定量方法,其檢測限為6~13ppm,定量限為20~41ppm。范婷婷等采用SHISEIDO C18型色譜柱(4.6mm×250mm,5µm)建立了HPLC-PDAD測定纈沙坦中N-二甲基亞硝胺含量。檢測限為0.01ppm,定量限為0.03ppm。
4.1.2 熒光檢測器與化學發光檢測器
當然,紫外檢測器用于亞硝胺類雜質的檢測存在著很多挑戰。首先需要對液相色譜條件優化,比如流動相組成、pH等需要花費較長時間。此外,HPLC-UV方法的檢測限和定量限也較高。為了降低檢測限和定量限以達到遺傳毒性雜質測定的需要,可以通過熒光衍生化法(fluorescence derivatizatio,FLD)或化學發光檢測法(HPLC-PR-CL)進行檢測。
由于亞硝胺類遺傳毒性雜質結構中無熒光基團,因此需采用熒光衍生化法進行熒光標記,以提高檢測靈敏度。Zhao等采用柱前熒光標記建立了高效液相色譜-熒光檢測法(HPLC-FLD)測定食品中N-亞硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亞硝基二乙胺(N-nitrosodiethylamine,NDEA)、N-亞硝基二丁胺(N-nitrosodibutylamine,NDBA)和N-亞硝基二丙胺(N-nitroso-di-N-propylamine,NDPA) 4種亞硝胺雜質方法。該方法檢測限在1.3~2.5ng/L范圍內。Takahiro等采用Capcell Pak C18MGII(5μm,4.6mm,250mm或100mm)色譜柱建立了高效液相色譜-光化學反應-化學發光法(HPLC-PR-CL)分析再生水中NDMA的含量。檢測限為2ng/mL。該方法與固相萃取-氣相色譜串聯質譜法相比具有相同的準確度。但其具有比該法樣品用量小、分析時間快、操作方法簡單等優點。
上述方法論述了對藥品、食品和水中亞硝胺類遺傳毒性雜質的檢測方法和檢測限,檢測限可達到1~13ng/mL不等。可根據遺傳毒性雜質的性質和含量選擇合適的檢測方式。但考慮到遺傳毒性雜質的含量通常較低,常規液相色譜法只適用于含量較高的遺傳毒性雜質的定量,因此HPLC的檢測限也往往達不到要求,需要靈敏度更高的檢測器來解決。
4.1.3 質譜檢測器
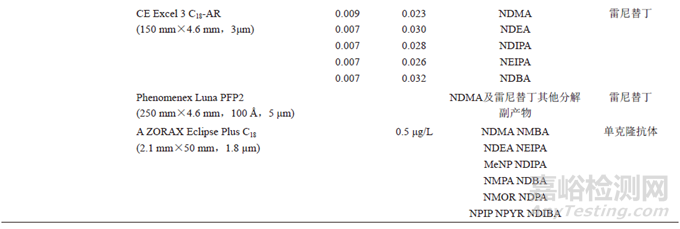
由于較高的靈敏度,LC-MS法已被廣泛探索用于分析含量較低的遺傳毒性雜質當中。表3總結了FDA先后建立了液相色譜串聯高分辨質譜法(liquid chromatography tandem high resolution mass spectrometry,LC-HRMS)對血管緊張素Ⅱ受體拮抗劑類藥物、雷尼替丁、利福平、利福噴丁中遺傳毒性藥物檢測方法。
采用電噴霧離子源(electrospray ionization,ESI)的質譜多為高分辨質譜和串聯三重四級桿質譜。FDA公布的幾種亞硝胺類遺傳毒性雜質的檢測方法為高分辨質譜。因其分辨率高、質量精密度高等優點被廣泛應用在藥品檢測中。Wohlfart等通過FDA的方法對15批利福平膠囊中的遺傳毒性雜質MNP檢測。該方法采用標準曲線法定量,檢測結果為0.7~5.1ppm。其中一份樣品的測定結果略微大于FDA規定的上限(5ppm)。同時,該研究指出,FDA采用的外標單點法可能由于個別樣品中MNP濃度超過了標準曲線法的線性范圍,而導致結果不準確。劉博等建立LC-ESI-HRMS法測定54批鹽酸二甲雙胍緩釋片中7種亞硝胺雜質的檢測方法。此外,LCMRM-MS也廣泛應用于藥物中遺傳毒性雜質的檢測中。Tao等建立了HPLC-ESI-MS/MS方法檢測30批利福平制劑中遺傳毒性雜質MNP的含量。該方法與六通閥切換相結合,避免了利福平進入質譜儀造成污染。
采用LC-MS技術對遺傳毒性雜質進行檢測時,藥品中的輔料、雜質可能會對待測成分產生基質效應,對檢測結果造成影響。有文獻表明,與ESI離子源相比,使用大氣壓化學電離源(atmospheric-pressure chemical ionization,APCI)時,基質效應較小。同時,APCI源的靈敏度要高于ESI源,且APCI源更適合一些難離子化的化合物。
APCI離子源在藥物雜質檢測中應用范圍較廣,常見的化學藥品(雷尼替丁、二甲雙胍、沙坦類等)中的亞硝胺化合物都可采用APCI離子源檢測。此外,APCI離子源還可用于生物制品中遺傳毒性雜質的檢測,Luo等采用鹽析液液萃取(salting-out liquid-liquid extraction,SALLE)前處理技術建立了SALLE-LC-APCI-MS/MS法測定單克隆抗體中的13種亞硝胺雜質的方法。這是首次為生物制藥中亞硝胺遺傳毒性雜質的定量提供了一種可靠而靈敏的方法。
表4總結了上述文獻中亞硝胺類雜質LC-MS檢測方法。
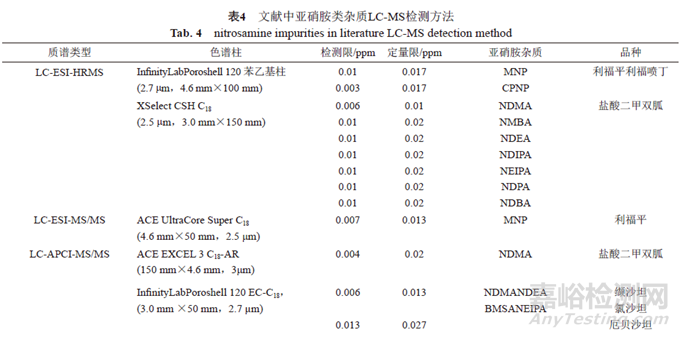
綜上所述,液相色譜串聯質譜檢測技術由于具有靈敏度高等特點,已成為ppm級別的遺傳毒性雜質定量檢測的常用方法。色譜柱多采用C18或苯基柱。APCI源和ESI源均可應用于藥物中亞硝胺類遺傳毒性雜質的檢測,但采用APCI源的基質效應風險通常低于采用ESI源。
由于遺傳毒性雜質含量較低,為了保證較好檢測結果,往往需要向質譜中注入較高濃度的樣品。但是,對于沒有經過前處理的樣品,直接進樣會使高濃度的主成分進入離子源,對質譜儀造成污染。因此,可以通過固相萃取(solid phase extraction,SPE)、固相微萃取(solid phase microextraction,SPME)和分散液-液微萃取等方法或閥切換技術連接在線樣品處理技術對樣品進行前處理。
4.1.4 氣相色譜法
雖然質譜串聯熱能分析儀(gas chromatography tandem thermal energy analyzer, GC-TEA)聯用也可應用于遺傳毒性雜質的檢測中,但GC-MS更為普遍。
表5總結了FDA先后建立的直接進樣(direct injection, DI)氣相色譜串聯質譜法(DI-GC-MS)和頂空(headspace, HS)氣相色譜串聯質譜法(HS-GC-MS)對沙坦類藥物中亞硝胺類遺傳毒性藥物的檢測方法。
DI-GC-MS精密度較高,重復性好,適合液體進樣,但進樣時可能會有主成分造成的干擾。目前DI-GC-MS已用于很多藥品(纈沙坦、西洛他唑、蘋果酸舒尼替尼、奧美沙坦酯、阿莫西林等)中遺傳毒性雜質的定量檢驗。
頂空進樣法適合揮發性較大的雜質。該方法將樣品置于頂空瓶中,只抽取樣品中揮發性氣體進行測定,大大減少了樣品基質對被分析物的干擾。同時,該方法具有無須復雜的前處理過程且操作簡單的特點。Wichitnitnithad等建立了HS-GC-MS法檢測10批纈沙坦原料藥中遺傳毒性雜質含量的方法。Lee等建立了無溶劑(SF)-HS-GC/MS對原料藥和制劑中NDMA進行檢測,與傳統的HS-GC/MS和LC-MS/MS方法相比,該法對NDMA的快速篩選更加方便,不需要樣品前處理。具有較高的靈敏度和選擇性。
需要注意的是,無論使用直接進樣還是頂空進樣,GC-MS最大的挑戰在于待測主成分的遺傳毒性雜質在高溫下有增加的風險。Lim等建立了一種GC-MS/MS同時測定沙坦類、二甲雙胍和雷尼替丁等8種藥品中遺傳毒性雜質的方法。該方法采用沉淀法和固相萃取法進行前處理。該方法在去除藥物和輔料的同時,NDMA和NDEA得到了有效的回收。是一種方便可行、靈敏度高、專屬性好、準確性和精密度較高的檢測方法。該法通過前處理除去了主成分,使得雷尼替丁這種受熱易分解的藥物也可用GC-MS/MS法檢測,為此類藥物的檢測提供了可替代的方法。Alshehri等建立了HS-SPME-GC-MS法檢測雷尼替丁中遺傳毒性雜質NDMA。該法采用固相微萃取技術,制備過程簡單,采用低溫從而避免了雷尼替丁受熱分解,可用于其他受熱易分解藥物的遺傳毒性雜質檢測。Chang等采用固相萃取前處理法建立了HS-SPME-GC-MS/MS檢測44種藥物中14種亞硝胺的方法。
GC也可與TEA聯用,但該儀器價格昂貴,故適用范圍比較小。GC-TEA的原理是熱能分析儀能特異性催化亞硝胺類化合物裂解成一氧化氮(NO)基團,與臭氧反應后會產生近紅外光,利用光電倍增管檢測,從而對亞硝胺類化合物的含量進行測定。咸瑞卿等建立了GC-TEA法檢測13批纈沙坦原料藥及其制劑中NDMA含量。GC-TEA法相對于GC-MS,減少了背景和基質干擾,避免了采用GC-MS法時定性、定量離子保留時間附近有較多干擾峰的問題,保證了低濃度樣品的定量準確性。但由于其價格昂貴,通常不作為亞硝胺類雜質的檢測方法。
表6總結了上述文獻中亞硝胺類雜質GC-MS檢測方法。
以上內容總結了近年來氣相色譜串聯熱能分析儀和質譜檢測亞硝胺類遺傳毒性雜質的分析方法。GC-MS相對于LC-MS具有分析速度快、操作簡單、成本低等特點,雖然應用范圍較LC-MS窄,主要適用于易揮發性成分的分離檢測,但也是遺傳毒性雜質檢測不可或缺的方法。直接進樣法相對于頂空進樣法的靈敏度高,但可能會有主成分或者輔料等干擾造成的基質效應,該基質效應是待測樣品與硅醇基或玻璃襯管表面金屬離子間的相互作用所導致。這些基質成分有利于被測樣品轉移至檢測器,從而導致較高的分析信號。因此,GC-MS中的基質效應更多表現為基質誘導增強效應,產生假陽性。為了避免這種干擾,要考慮色譜條件和前處理方法的優化。選擇合適的內標可以校正測量過程產生的誤差,是避免基質效應的有效方法。同位素內標法常用于計算檢測結果。除此之外,還可采用固相萃取法、沉淀法等除去主成分和輔料的干擾。頂空進樣收集揮發性氣體進行檢測,操作簡單,無須前處理。同時結合固相微萃取技術,可顯著降低復雜基質的干擾,增加檢測靈敏度,并且適用于受熱不穩定樣品的檢測。SPME是一種附加在注射針上的輔助纖維萃取技術,可用于在樣品分析前提取目標分析物。SPME結合HS-GC-MS法已廣泛應用在遺傳毒性雜質檢測中。
由于微量水平的遺傳毒性物質也會對服藥者造成不可逆轉的危害,可能會引發腫瘤甚至癌癥的風險,并且其引發的致癌風險可能與使用的劑量沒有相關性,存在遺傳毒性化合物在極低劑量水平下導致人體DNA損傷,且該損傷效應有通過遺傳物質的復制而不斷放大的風險。因此各國監管機構要求對藥品中遺傳毒性雜質進行嚴格控制。而對于制劑中的遺傳毒性雜質檢測,由于成分復雜,制劑中的輔料可能會引起基質效應,從而影響遺傳毒性雜質檢測結果的準確。目前,多是根據不同品種、不同生產企業去建立相應的檢測方法,使得監管效率降低。可以嘗試通過在線閥切換、固相萃取等方式建立前處理方法,使得檢測方法更有通用性。此外,近年來,隨著各國對遺傳毒性雜質的研究逐漸深入,對于遺傳毒性雜質認知也發生了變化。監管機構對遺傳毒性雜質的控制也更加科學、合理。生產企業通過采用“避免-控制-清除”的策略,使實際工藝中所有可能涉及的遺傳毒性雜質風險得到明確鑒別和控制,是達到監管期望的有效途徑。
本文從監管機構對藥品中遺傳毒性雜質的監管策略、遺傳毒性雜質來源、檢測方法及清除策略4個方面進行了綜述,為藥品中遺傳毒性雜質的控制/清除、檢測提供了參考和依據。
來源:《中國抗生素雜志》 2024年1月 第49卷第1期
















