您當前的位置:檢測資訊 > 法規(guī)標準
嘉峪檢測網 2025-03-20 09:00
摘要
目的 通過分析歐洲、美國、日本藥典藥用輔料標準與 ICH Q3D 的協(xié)調策略和實施情況,為完善《中國藥典》藥用輔料標準體系,推動藥典標準與 ICH Q3D 協(xié)調提供有益的參考和借鑒。方法 采用文獻研究和個例分析方法,分別介紹歐洲、美國、日本 3 個主要國家和地區(qū)的藥典在藥用輔料領域實施 ICH Q3D 的政策策略及藥用輔料各論的更新情況,分析各國藥典與 ICH Q3D 協(xié)調的特點。結果 各國藥典藥用輔料實施 ICH Q3D 的策略各有特點,且實施進程不同,在元素雜質標準的設置上尚存在較大差異。結論 推動藥典藥用輔料標準與 ICH Q3D 的協(xié)調工作是一項具有挑戰(zhàn)的長期工作,有必要制定符合中國國情的協(xié)調策略。
【關鍵詞】 歐洲藥典;美國藥典;日本藥典;藥用輔料;ICH Q3D;元素雜質
藥品中有多種來源可引入元素雜質,包括合成反應中催化劑殘留、藥用輔料中存在而引入,或者生產設備、包裝系統(tǒng)因相容性而引入等,由于元素雜質不能為患者提供任何治療作用,因此它們在藥品中的含量需要被控制在可接受的限度范圍內[1]。為了建立全球統(tǒng)一的元素雜質研究指南,國際人用藥品注冊技術協(xié)調委員會(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use,ICH)于 2014 年11 月正式發(fā)布實施《Q3D:元素雜質指導原則》(簡稱 ICH Q3D)。該指導原則通過評估潛在元素雜質的毒性數(shù)據(jù),確定 24 種元素的每日允許暴露量,并給出基于風險管理理念的藥品中元素雜質的控制方法。ICH Q3D 隨后經過兩次更新,最新版 ICH Q3D(R2)已經在2022 年經過管理委員會批準并推薦各監(jiān)管機構成員采納[2]。我國于 2017 年 6 月加入 ICH,于 2020 年 1 月通過發(fā)布 ICH 適用性公告采用 ICH Q3D(R1),并明確“公告發(fā)布之日起6 個月后開始的藥學研究適用該指導原則”,即從 2020 年 7 月之后新上市藥品需按照 Q3D(R1)開展研究。從此,ICH Q3D 在我國開始進入實施階段[3]。2023 年 1 月國家藥品監(jiān)督管理局發(fā)布公告并決定自 2023 年 7 月 29 日始,新的藥學研究適用 Q3D(R2)[4],同時停止實施 Q3D(R1)。
藥品中元素雜質的風險來源于原料藥、輔料、生產設備、包裝系統(tǒng)等各部分引入風險的加和,而藥用輔料作為藥品中主要組成部分,亦是藥品中元素雜質風險來源的主要部分。同時,藥用輔料因其天然來源的占比高,在不同制劑中的用途、用法、用量差異大等原因,給制定藥典這種通用要求的標準法典增加難度,故主要國家和地區(qū)藥典都在進行 ICH Q3D 協(xié)調中,針對藥用輔料標準的元素雜質問題有專門的考慮。
本文采用文獻研究和個例分析方法,分別介紹歐洲、美國、日本 3 個主要國家和地區(qū)的藥典在藥用輔料領域實施 ICH Q3D 的政策策略,以及藥用輔料品種標準的更新情況,分析各國藥典與 ICH Q3D 協(xié)調的特點,以期為完善我國藥典藥用輔料標準體系,推動藥典標準與 ICH Q3D 協(xié)調提供有益的參考和借鑒。因篇幅有限,本文著重于分析梳理歐洲、美國、日本藥典的協(xié)調特點及進程,對《中國藥典》藥用輔料標準如何與 ICH Q3D 協(xié)調的問題將另文探討。
1.《歐洲藥典》(European pharmacopeia,EP)藥用輔料標準與 ICH Q3D 的協(xié)調策略
1.1 歐洲實施 ICH Q3D 的總體框架
ICH Q3D 之前,歐洲藥品管理局(European MedicinesAgency,EMA)便發(fā)布旨在控制原料藥及藥用輔料合成中引入的金屬催化劑和金屬試劑殘留的指導原則(簡稱金屬催化劑指導原則)[5],這一指導原則基于患者安全風險的考慮,給出 14 種元素的每日允許暴露量(permitted daily exposure,PDE),并給出各元素的限度要求,如果原料藥或藥用輔料進行控制,一般無需在制劑中進行控制。金屬催化劑指導原則于 2008年 9 月 1 日開始在新上市藥品中實施,2013 年 9 月 1 日開始在已上市藥品中實施,EP 在 8.0版通則 5.20 全文收載這一指導原則[6],由于與 ICHQ3D 的實施時間交叉,2034 藥用物質總論中并未引入這一指導原則,即金屬催化劑指導原則并未與 EP 強制法定綁定(legallybinding)。由于催化劑的使用是與生產工藝相關的,因此 EP 在其各論中通常不收載單獨元素的檢查項,而是以重金屬檢查的方式進行元素雜質的控制。在金屬催化劑指導原則實施 1年后,2009 年 10 月,ICH 開始啟動制定新的指導原則 Q3D,新的指導原則不僅考慮原料藥及藥用輔料中催化劑引入的元素雜質,還考慮其他來源的雜質,同時 ICH Q3D 將元素的種類從 14 種修訂至 24 種,并修改部分元素的 PDE,同時引入元素雜質風險評估的概念。ICH Q3D 在 2014 年 11 月被批準后,EMA 在 2015 年 1 月發(fā)布本地區(qū)的 ICH Q3D 實施版本,并確定新上市藥品實施日期為 2016 年 6 月,已上市藥品實施日期為 2017 年 12 月,歐洲實施金屬催化劑指導原則及 ICH Q3D 轉化的重要時間節(jié)點見圖 1。
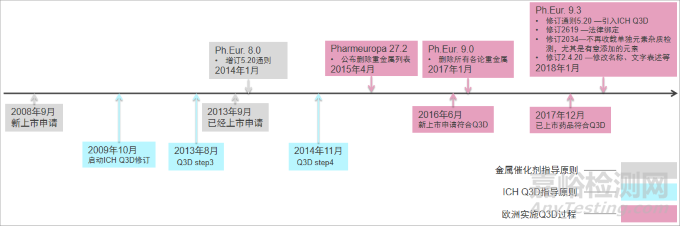
▲圖 1-《歐洲藥典》實施 ICH Q3D 的時間線
歐洲藥品質量管理局(European Directorate for the Quality of Medicines, EDQM)作為 EP的管理機構,分別在 2014 年 7 月[7]、2015 年 4 月[8]、2015 年 8 月[9]和 2017 年 1 月[10]次公布其有關ICH Q3D的實施策略,主要包括:①法定綁定。EP9.3修訂了通則5.20[11],用ICHQ3D替代原來的金屬催化劑殘留限度要求,同時修訂制劑通則 2619[12],從而將 ICH Q3D 的要求作為藥品普遍適用的原則納入 EP,使其成為歐洲藥品的強制要求。此外還修訂通則 2034 藥用物質[13],強調生產企業(yè)作為第一責任人對生產過程可能引入的雜質具有風險管理責任,原則上藥典各論中不再收載元素雜質相關檢查。②刪除各論中的重金屬。EP 在其論壇 27.2上公布需要刪除重金屬的相關各論[14],并在 EP9.0 中正式生效。③特定元素雜質檢查項去留。EDQM 在其 2015 年 4 月的官方聲明中提到,除非有正當理由,ICH Q3D 生效后,1 類、2A 類、2B 類、3 類元素雜質的檢查項也應該被刪除。2017 年 1 月給出保留元素雜質檢查的特例情況,即天然來源物質中的特定元素雜質檢查將會保留,非天然來源的將會刪除,對于ICH Q3D 中尚未建立 PDE 的“其他”元素(如鋁、鐵等),EDQM 建議保留這些元素的檢查。
1.2 EP 藥用輔料各論的特殊考慮
EP 通則 2034 藥用物質既包括原料藥,也包括藥用輔料,因此上述實施過程也包含了對藥用輔料的要求。EP9.3 實施后,刪除各論中所有重金屬檢查項;EDQM 在 2017 年提出保留天然來源的物質中特定元素雜質的檢測項后,在 2020 年更新發(fā)布了專門針對藥用輔料中元素雜質處理的政策[15],其策略可總結為以下幾點。①天然來源的藥用輔料由于固有元素雜質的存在,是藥品中元素雜質的主要潛在來源之一,暫時保留這些特定元素雜質檢測,待積累一定數(shù)據(jù)后,再逐步考慮增刪去留。②持續(xù)收集數(shù)據(jù)并審查天然來源藥用輔料的元素雜質數(shù)據(jù),必要時修改檢查項限度,以使其更加符合歐洲市場流通樣品的實際水平。如果發(fā)現(xiàn)某些特定元素雜質與工藝相關或者實際未檢出,即刪除這些特定元素檢查項。如果持續(xù)檢測到或發(fā)現(xiàn)新的特定元素雜質,即保留或增加特定元素檢查項,并基于檢測數(shù)據(jù)設定合理限度。③采用口服控制閾值的方法進行風險評估,適當時考慮注射給藥方式。如果批檢驗數(shù)據(jù)顯示某元素殘留水平持續(xù)高于控制閾值,如果是已有檢查項,則保持限度不變或者更新限度;如果是新的元素,則新增元素檢查項,并設置合理限度。④所有特定元素雜質檢查項,只給出元素種類及限度列表,具體方法由企業(yè)自行制定,并需符合通則 2.4.20 元素雜質檢測方法的驗證要求。
EP 從 EP9.8 開始至今已完成大多數(shù)藥用輔料品種的元素雜質風險評估工作,有關具體內容另文詳述。
2.《美國藥典》(United States pharmacopeia,USP)藥用輔料標準與 ICH Q3D 的協(xié)調策略
2.1 美國實施 ICH Q3D的總體框架
USP官網元素雜質更新專欄[16]列出USP實施ICH Q3D的詳細歷程,感興趣者可以參考學習,由于這一歷程較為復雜,以下僅對關鍵節(jié)點(圖 2)做簡要的解讀和分析。
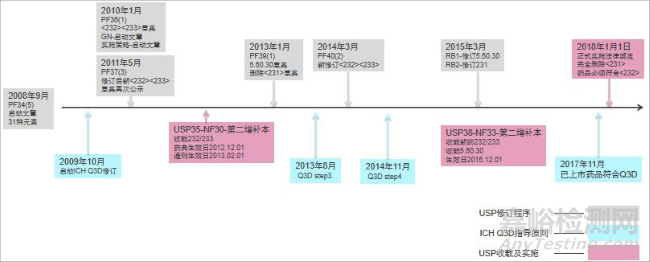
▲圖2-USP 實施 ICH Q3D 的時間及策略
USP 早在 1995 年便了解到通則 2.4.8 收載的濕化學的重金屬檢查法的諸多缺陷[17],2008年以前一直努力通過修訂該方法來彌補這些缺陷,但均未取得滿意結果,隨后轉向建立基于毒性考慮的金屬元素限度方法來控制特定元素在藥品中的殘留,以取代原有通則 2.4.8 重金屬檢測。2008 年 USP 的重金屬專家組在 PF34(5)上發(fā)表關鍵的啟動文章[18]給出了最初31種元素的限度以及有關檢測方法的要求,隨后又給出修訂思路[19]。這些思路基本要點包括:①建立新的有關金屬元素及其限度的通則<232>。②建立新的有關金屬元素檢測方法的通則<233>,提供 ICP-OES 和 ICP-MS 兩種檢測方法,并給出自擬方法需要的方法學驗證要求。③增加凡例中有關通則<232>適用性的描述,使其適用于所有各論,并建議實施時間為 2013年 9 月。
2010 年在藥典論壇 PF36(1)上公布最初的通則<232>及<233>草案[20],其中<232>草案收載 16 種元素,將元素分為 1 類和 2 類,其中 1 類為砷、鎘、鉛、汞四個元素,2 類為EMA 金屬催化劑殘留指導原則中的 12 種元素,<233>草案給出基于方法性能要求的合規(guī)框架。同時在 PF36(1)上公示的還有其實施計劃。計劃在 USP35-NF30 第二增補本發(fā)布,2012年 12 月生效,并計劃通過凡例 5.60.30 的修訂在 2013 年 9 月實施。隨后,USP 在 PF39(1)公示凡例 5.60.30[21]草案,計劃收載在 USP37-NF32 中,并計劃將實施日期推遲到 2014 年 5月 1 日。
USP35-NF30 第二增補本發(fā)布后,收載新的<232>及<233>通則,雖然 USP 表示<232>及<233>兩個通則不被引用時不具有強制性,但還是遭到行業(yè)的強烈抵制,希望推遲實時間及與 ICH Q3D 限度保持一致。為此,USP 組建專門的顧問團來處理實施相關問題。隨后,USP 經過與 ICH Q3D 第二階段草案協(xié)調后,修訂<232>通則中的元素種類及限度,最大程度保持了與當時 ICH Q3D 的協(xié)調,新的通則<232>在 PF40(2)上公示并計劃在 USP38-NF33第一增補本上隨新的凡例 5.60.30 同時發(fā)布,并計劃于 2015 年 8 月 1 日實施。隨后改為在USP38-NF33 第二增補本發(fā)布,即 2015 年 12 月實施。2015 年 3 月,USP35-NF30 第增補本發(fā)布前,為與 ICH Q3D 的時間保持一致,USP 發(fā)布兩條修訂公告[22] ,將通則<232>的實施日期修改為 2018 年 1 月 1 日,同時將刪除重金屬的實施日期修改到同一天,至此 USP 正式將元素雜質控制的方法完全引入到所有藥品中。根據(jù)凡例 5.60.30 的修訂公告,在 2018 年 1月 1 日前可以提前采用新的通則<232>,提前采用新的通則<232>并符合規(guī)定的藥品及其組分可以不用執(zhí)行<231>重金屬檢測。2018 年 1 月,USP 如期刪除所有各論中的重金屬,并使通則<232>適用所有藥品,正式將 ICH Q3D 法定綁定至 USP。
對于 USP 中還存在的 7 個特定元素雜質的通用檢測方法以及近千條各論中的特定元素的限度,USP 通則及化學分析專委會(GC-CA)在 PF42(4)[23]的啟動文章中給出處理思路:①除非有已知質量或安全方面相關的原因不能刪除外,實施通則<232>意味著無需在各論中收載特定元素雜質限度檢查,因此建議刪除這些檢查項,以避免混淆及重復的檢測。②通則<233>的存在,即無須再收載特定元素雜質的通用檢測方法。③涉及的相關各論有 1000個左右,包括藥用輔料、原料藥及其制劑、膳食補充劑、食品、生物制品等。④刪除各論中的特定元素雜質檢查是一個漫長的過程,需要廣泛的參與和討論。
2.2 USP 藥用輔料的特殊考慮
為配合各論中元素雜質處理的總體策略,2020 年 USP 藥用輔料專委會制定藥用輔料各論中特定元素雜質的處理策略[24],其大致思路如下。①首先考慮在 USP 中有通用檢測方法的 7 個特定元素(鋁、砷、鐵、鉛、汞、硒、鋅),對各論中涉及這些特定元素的檢查項按照所采用的檢測方法進行優(yōu)先級分類,優(yōu)先處理直接引用通則方法的項目,其次處理單獨的濕化學檢查法的項目,最后處理采用單獨儀器方法的項目,并給出了不同級別涉及的檢查項及各論。②對不同優(yōu)先級處理的各論,給出需要刪除或修訂的建議。③其余特定元素的處理,參考 EP 對藥用輔料品種的處理方式,對天然來源的藥用輔料按品種單獨確定元素雜質檢查項的修訂方式。④擬參考 EP,各論中只給出限度,并引用一個特定元素檢查的通用方法。⑤給出 USP 藥用輔料各論中特定元素雜質的收載情況及計劃處理方式,這些元素既包括了 ICH Q3D 中的 24 種元素,還包括其他元素(如鐵、鋁、鎂及堿土金屬等),向公眾征求更多關于藥用輔料來源,檢測方法以及特定元素雜質風險的意見,必要時進行刪除或者修訂。
截至目前,USP 完成鋁、砷、鐵、鉛、汞、硒 6 個特定元素檢查方法的修訂,引入了符合通則<233>要求的儀器方法(ICP-OES 法和 ICP-MS 法)。具體品種特定元素檢查項的評估及處理工作進展較緩,有關品種的詳細情況另文詳述。
3.《日本藥典》(Japanese pharmacopeia,JP)藥用輔料與 ICH Q3D 的協(xié)調策略
3.1 日本實施 ICH Q3D 的時間線
在 ICH Q3D 正式實施后,日本厚生勞動省 MHLW 及其下屬的獨立行政法人機構 PMDA 頒布了本地區(qū)范圍內的元素雜質控制策略(見圖 3)。
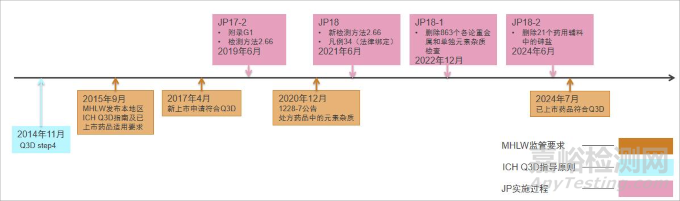
▲圖3-JP 實施 ICH Q3D 的時間及策略
MHLW 在 2015 年 9 月 30 日發(fā)布本地區(qū) ICH Q3D 的適用通告(0930-4 號公告)[25],通告指出已上市藥品需要在2017年4月1日之后滿足 ICH Q3D 的要求,同時指出ICH Q3D給予已上市藥品36個月的過渡期,日本當局將在以后給出已上市藥品的適用時間。
2019 年 6 月,《日本藥典》JP17-2 開始引入 ICHQ3D, 包括增加一個一般試驗法通則<2.66>元素雜質檢測方法,對應 EP2.4.20 以及 USP<233>,然后在參考信息 G1 部分增加元素雜質的限度以及風險評估與控制的內容,對應 ICH Q3D。此時日本已上市藥品還是按照藥典中的重金屬、砷鹽等方法進行控制,但這一步無疑預示未來元素雜質控制的方向。
2020 年 12 月,隨著新版藥典 JP18 即將實施,MHLW 發(fā)布已上市藥品適用 ICHQ3D 的公告 1228-7 號通告[26]。將 ICH Q3D 以及新版藥典 JP18 中凡例 34 的適用范圍擴大到所有處方藥,包括藥典收載的和未收載的品種。明確適用范圍、實施時間、實施辦法等,明確規(guī)定在新藥典頒布實施 36 個月后,即 2024 年 7 月 1 日起,所有藥典收載及未收載的處方藥必須符合 JP18 中通則<2.66>的控制要求。
2021 年 6 月,MHLW 發(fā)布新版藥典 JP18。新的<2.66>通則將 JP17-2 中原通則<2.66>與參考信息 G1 中的內容統(tǒng)一為一個通則,并新增一條凡例 34 將新的<2.66>通則的要求法定綁定至所有藥品。新的凡例 34 條規(guī)定[27]:原則上,JP 收載的藥品應根據(jù)元素雜質通則<2.66>進行適當控制。當藥品中的元素雜質按其進行適當控制后,該藥品及其原料藥、藥用輔料可不必測試藥典相應各論中所指定的重金屬和砷等元素雜質的檢查項。
為了處理藥典中與新的通則<2.66>元素雜質控制要求沖突的重金屬及砷鹽等檢查項,配合 JP18 中元素雜質的實施,PMDA 在 2021 年 12 月發(fā)布刪除相關各論中的重金屬及特定元素雜質檢查項的策略及清單[28],擬刪除內容將收載在 JP18 第一增補本中。2022年12月12日,JP18-1 發(fā)布[29],刪除包括化學藥、抗生素、生物藥、藥用輔料共 863 個各論中的重金屬及砷鹽檢查項。
3.2 JP 藥用輔料標準的特殊考慮
對于 JP 收載的藥用輔料品種中的元素雜質檢查項,JP 采取了與 EP 和 USP 類似的單獨處理的原則,在 2021 年 JP 發(fā)布的刪除各論中特定元素檢查項的策略中,各論分為兩類:一類是化學藥、抗生素和生物藥;另一類是藥用輔料。與第一類直接發(fā)布刪除清單不同,對于第二類藥用輔料各論中的特定元素雜質檢查項,JP 認為由于天然來源藥用輔料固有的元素雜質風險,有必要對藥用輔料中可能存在風險的部分元素雜質在各論中進行額外的控制,JP評估完成后將向社會公布處理方式。2022 年12 月發(fā)布的JP18-1版本中刪除了 74 個藥用輔料各論中的重金屬檢查項,及部分砷鹽、鋇鹽、鉛等特定元素檢查項。2024 年 6 月發(fā)布的 JP18-2 版本中再次刪除 21 個藥用輔料中的砷鹽檢查項[30],具體品種及有關檢查項的處理情況將另文詳述。
由于日本在藥用輔料標準制定上形式多樣,除了 JP 收載部分藥用輔料外,尚有一部專門的法定藥用輔料標準《醫(yī)藥品添加物規(guī)格》收載大量 JP 上未收載的藥用輔料,根據(jù) 1228-7號公告,按照通則<2.66>進行有效的風險評估與控制的藥品,其藥用輔料如果收載在《醫(yī)藥品添加物規(guī)格》中,則其中的重金屬及特定元素雜質檢查項也不用再檢查。
4.EP、USP、JP 元素雜質協(xié)調的異同
在實施時間上,歐洲和美國由于在 ICH Q3D 協(xié)調之前以及在 ICH Q3D 開發(fā)的過程中即同步開展本地區(qū)元素雜質相關新標準新要求的推進工作,因此均在 ICH Q3D 頒布約 3 年后完成本地區(qū)藥典的實施綁定工作,與 ICH Q3D 內在的時間要求基本吻合。日本在 ICH Q3D正式開發(fā)完成后才開始本地區(qū)元素雜質的新標準推進工作,且與 EP,USP 比較,JP 更新較慢,所以在 2014 年 12 月 ICH Q3D 頒布近 10 年后才完成本地區(qū)藥典的實施綁定。
由于 EP、USP、JP 體例及適用性上的差異,在引入 ICH Q3D 的方式上,EP 直接引用ICH Q3D,并在制劑通則和藥用物質通則這一層引入元素雜質的控制要求;USP 及 JP 均通過本地區(qū)元素雜質通則間接引入 ICH Q3D,并通過一個新凡例將其與藥典法律綁定。
在各論及相關通則的處理上,EP 保留重金屬檢查法通則以供獸藥部分使用,刪除所有人用藥中的重金屬檢查項,對藥用輔料中的特定元素檢查項經過風險評估后確定保留的項目;USP 刪除了重金屬檢查法,修訂 7 個特定元素雜質的通用檢查方法;JP 保留重金屬檢查法,JP 將化學藥與藥用輔料進行分開考慮,刪除了化學藥中的重金屬和特定元素雜質檢查,對藥用輔料中的重金屬及特定元素雜質檢查采用分步評估后修訂的方式。EP、USP、JP 實施ICH Q3D 對比見表 1。
▲表1-EP、USP、JP 實施 ICH Q3D 對比表

5.討論
5.1 藥典藥用輔料標準與 ICH Q3D 的協(xié)調需要標準體系全方位統(tǒng)籌推進
首先,在實施時間上,歐洲、日本均用近 9 年,美國用近 10 年時間才完全用 ICH Q3D 取代重金屬,而目前各國藥典在元素雜質項目設置及方法上尚未完全協(xié)調,而這將是未來長期的過程,可見這個指南實施上的復雜性。其次,實施過程中,各國藥典在其網站均設立專門的 ICH Q3D 實施模塊,以便及時公布并調整相關政策要求,使各利益相關方了解實施全貌和進程并及時反饋意見,同時各國藥典均設置了過渡期的政策,可見實現(xiàn)從重金屬向 ICH Q3D 的跨越是一件相對復雜的系統(tǒng)工程,需要全方位的統(tǒng)籌推進。最后,從 EP、USP、JP 藥用輔料實施 ICH Q3D經驗可知,藥用輔料各論作為藥典的一部分,在與 ICH Q3D 的協(xié)調過程中始終與藥典整體協(xié)調保持一致,既相互依存,又相對獨立。藥典凡例、通則、指導原則等通用要求部分,由于具有普適性,應與藥用輔料各論整體通盤考慮、統(tǒng)籌推進。
5.2 藥典藥用輔料標準與 ICH Q3D的協(xié)調有必要“按品種單獨處理”
按照ICH Q3D的要求,制劑中元素雜質的有效控制必須以原料藥、藥用輔料等元素雜質的風險評估為基礎,藥用輔料通常在制劑中占比最大,帶入制劑中元素雜質的可能性和比例也最大。尤其是藥用輔料來源廣泛,天然來源藥用輔料占比較大,其中所含元素雜質較合成來源的藥用輔料及原料藥含量更高、差異更大,不同品種藥用輔料在制劑中的用途、用法、用量差異也較大,因此參考EP、USP、JP 實施經驗,有必要本著“按品種單獨處理”的原則,在對藥用輔料來源、生產工藝、批檢驗數(shù)據(jù)等充分考慮的基礎上,確定各論中元素雜質檢查的設定。推動藥典藥用輔料標準與 ICH Q3D 的協(xié)調工作是一項具有挑戰(zhàn)的長期工作,有必要制定符合中國國情的協(xié)調策略。
參考文獻
[1] ICH.ICH Q3D(R2):Guideline for Elemental Impurities[EB/OL].(2022-04-24)[2024-03-06] .https://database.ich.org/site/default/files/Q3D-R2_Guideline_Step4_2022_0308.pdf.
[2] International Council for Harmonisation of Technical Requirements for Pharmaceuticals forHuman Use. ICH guideline Q3D (R2) on elemental impurities[EB/OL]. [2024-03-06].https://www.ich.org/page/q3d-guideline.
[3] 國家藥品監(jiān)督管理局.關于適用《Q2(R1):分析方法論證:正文和方法學》等 11 個國際人用藥品注冊技術協(xié)調會指導原則的公告(2020 年第 7 號)[EB/OL].(2020-01-10)[2024-03-06].https://www.nmpa.gov.cn/xxgk/ggtg/gtggtg/20200121171201430.html.
[4] 國家藥品監(jiān)督管理局.關于適用《Q3D(R2):元素雜質》《M10:生物分析方法驗證及樣
品分析》國際人用藥品注冊技術協(xié)調會指導原則的公告 (2023 年第 16 號)[EB/OL].(2023-01-19)[2024-03-06].http://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20230129262900169.html.
[5] Eurpean Medicines Agency.EMEA/CHMP/SWP/4446/2000 Guideline on the SpecificationLimits for Residues of Metal Catalysts or Metal Reagents[EB/OL].(2017-04-29)[2024-03-06].http://www.ema.europa.eu/docs/en_GB/documentlibrary/Scientific_guideline/2009/09/WC500003586.pdf.
[6] EDQM.EP 8.0[S].5.20. Metal catalyst or metal reagent residues.
[7] EDQM.Ph.Eur.commission validates its strategy regarding elemental impurities and the
implementation plan of the upcoming ICH Q3D guideline.[EB/OL]. (2014-07-18) [2024-03-06].https://www.edqm.eu/documents/52006/90469/Press%20Release%20%20Ph.%20Eur.%20Commission%20Validates%20its%20Strategy%20Regarding%20Elemental%20Impurities%20-%20July%202014.pdf/d85da61e-8c52-905a-0487ed73ae9411baversion=1.2&t=1637160370021&download=true.
[8] EDQM.Ph.Eur. policy on elemental impurities and timelines for revision of general and
individual texts.[EB/OL].(2015-04-28)[2024-03-06].https://www.edqm.eu/documents/52006/90194/Press%20release%20%20PhEur%20Policy%20on%20Elemental%20impurities%20-%2028%20April%202015.pdf/07e21a8b-1fce-6832-6324-bc09e4919701?version=1.1&t=1660643762204&download=true.
[9] EDQM.clarification for products outside of the scope of ICHQ3D.[EB/OL].(2015-08-07)[2024-03-06].https://www.edqm.eu/documents/52006/90194/Press%20release%20-%20Ph.%20Eur.%20Policy%20on%20elemental%20impurities%20-%20clarificatio
n%20for%20products%20outside%20the%20scope%20of%20the%20ich%20q3d%20guideline%20-%2007%20August%202015.pdf/3c83d15d-7441-e4ce-0e7e-309efa9ec99aversion=1.1&t=1660643630452&download=true.
[10] EDQM.update on the Ph.Eur.policy on elementalimpurities.[EB/OL].(2017-01-11)[2024-03-06].https://www.edqm.eu/documents/52006/86463/Press%20Release%20%20Update%20on%20the%20Ph.%20Eur.%20Policy%20on%20Elemental%20Impurities%20-%20January%202017.pdf/5a3e63a1-2d92-760b-28ba-aa9353d5a584?version=1.3&t=1637160370051&download=true
[11] EDQM.EP 9.3[S].5.20.Elemental impurities.4759.
[12] EDQM.EP 9.3[S].Pharmaceutical preparations.4775-4777.
[13 ] EDQM.EP 9.3[S].Substances for pharmaceutical use.4777-4779.
[14] EDQM.Pharmeuropa 27.2 deletion of the test of heavy metals(2.4.8)[EB/OL].(2015-04-01)[2024-03-06].https://pharmeuropa.edqm.eu/app/Archives/content/Archives-37177/Pharmeuropa_27.02E.pdf.
[15] EDQM. Update on the European Pharmacopoeia policy on elemental impurities-Excipients ofnatural orgin [EB/OL].(2020-03-31)[2024-03-06].https://www.edqm.eu/en/-/update-on-the-european-pharmacopoeia-policy-on-elementalimpurities-excipients-of-natural-origin?p_l_back_url=%2Fen%2Fsearchedqm%3Fq%3Delemental%2Bimp
urities.
[16] USP. Elemental impurities updates[EB/OL].(2023-01-17)[2024-03-06].https://www.usp.org/impurities/elemental-impurities-updates.
[17] United States Pharmacopeial Convention.2012-12-20_elemental_impurities_standards-setting_record-full.
[18] USP. PF34(5) stimuli to the revision process: general chapter on inorganic impurities: heavy metals[EB/OL].[2024-03-06].http://www.usppf.com/pf/pub/data/v345/GEN_STIMULI_345_pf345-stim1.xml.
[19] United States Pharmacopeial Convention. Recommendations to the general chapters expertcommittee by the metal impurities advisory panel for metal impuritiesstandards.[EB/OL].[2009-04-30]https://www.google.com.hk/url?sa=t&source=web&rct=j&opi=89978449&url=https://www.uspnf.com/sites/default/files/usp_pdf/EN/USPNF/metalAdvisoryPanel
Rec.pdf&ved=2ahUKEwjPxMbUq_eHAxUwk1YBHTGkBzEQFnoECBcQAQ&usg=AOvVaw25wL35uJHl4uWm-b9lD6Kc.
[20] USP. PF36(1)<232>elemental impurities-limits.<233>elementalimpurities-procedures[EB/OL].(2010-01-01)[2024-03-06].http://www.usppf.com/pf/pub/data/v345
/GEN_STIMULI_345_pf345-stim1.xml.8 / 9[21] USP. PF39(1) 5.60.30 elemental impurities in USP and NFarticles[EB/OL].(2013-01-01)[2024-03-06].http://www.usppf.com/pf/pub/data/v345/GEN_STIMULI_345_pf345-stim1.xml
[22] United States Pharmacopeial Convention, Revision Bulletin.Postponement, ‹232› elementalimpurities—limits and ‹233› elemental impurities—procedures [EB/OL].(2012-11-15)
[2024-03-06].https://www.uspnf.com/official-text/revision-bulletins/elementalimpurities-limits-and-elemental-impurities-procedures.
[23] USP. PF42(4) future of element-specific chapters in the USP-NF[EB/OL]. (2016-07-01) [2024-03-06]. http://www.usppf.com/pf/pub/data/v345/GEN_STIMULI_345_pf345-stim1.xml
[24] USP. General announcement. first draft of roadmap for addressing element-specific chapters and tests in excipient monographs[EB/OL].(2020-08-05) [2024-03-06].https://www.uspnf.com/notices/elemental-impurities-in-excipients-20200803
[25] MHLW.Guideline for elemental impurities in drug products. PFSB/ELD Notification No. 0930-4[EB/OL].(2015-09-30)[2024-03-06].https://www.google.com/url?client=internal-element-cse&cx=005876357619168369638:ydrbkuj3fss&q=https://www.mhlw.go.jp/web/t_doc%3FdataId%3D00tc1338%26dataType%3D1%26pageNo%3D1&sa=U&ved=2ahUKEwiUnt3Lp_eHAxVMr1YBHWsuDksQFnoECAcQAg&usg=AOvVaw0-LpPH6bob8tUBgbqbx1HI&arm=e
[26] MHLW. Handling of elemental impurities in prescription drugs. PSEHB/PED notificationNo. 1228-7[EB/OL].(2020-12-28)[2024-03-06].https://www.pmda.go.jp/files/000239969.pdf
[27] PMDA. Japanese pharmacopeia 18. general notice34[EB/OL].[2024-03-06].https://www.pmda.go.jp/files/000234145.pdf.
[28] PMDA.Briefing on removing heavy metals test and individual metal impurity test from
Japanese Pharmacopoeia(JP)Official Monographs after transition period for adopting the Control of Elemental Impurities ends. [EB/OL] .(2021-12-28)[2024-03-06].
https://www.pmda.go.jp/files/000243682.pdf.
[29] Japanese Pharmacopeia 18 supplement I English Version [S].2022:2845-2868.
[30 ] Japanese Pharmacopeia 18 supplement II Japanese Version[S].2024-06-28.

來源:醫(yī)藥導報


