您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-03-20 18:12
本研究旨在建立乳酸環丙沙星的微生物限度檢查方法以及乳酸環丙沙星氯化鈉注射液的無菌檢查方法。試驗方法嚴格遵循《中國藥典》2020 年版四部的相關規定進行方法適應性試驗。試驗結果顯示,乳酸環丙沙星原料藥采用微生物計數方法適用性試驗,各菌回收比值均在 0.5 ~ 2.0 之間;控制菌大腸埃希菌可檢出陽性試驗菌。乳酸環丙沙星氯化鈉注射液無菌檢查方法采用薄膜過濾法,6 種試驗菌均能檢出。基于以上結果,本研究得出結論:乳酸環丙沙星的微生物限度檢查方法以及乳酸環丙沙星氯化鈉注射液的無菌檢查方法,均適宜采用薄膜過濾法進行。
環丙沙星展現出了顯著的抑菌效果,目前在臨床上主要用于治療由敏感菌引起的泌尿系統和消化系統感染等疾病,屬于第三代喹諾酮類抗菌藥物 [1]。乳酸環丙沙星是環丙沙星與乳酸形成的鹽類,與環丙沙星相比,乳酸環丙沙星具有更高的藥物吸收率,以及抗菌譜廣、穿透力強、組織濃度高的特性 [2-4]。目前,藥品質量標準檢查項目中的微生物學檢查是確保用藥安全的關鍵指標之一 [5]。根據《中國藥典》2020 年版四部通則,對于需要控制藥品質量的微生物檢驗方法有明確的規定:必須對其相關檢查方法進行驗證 [6],以避免因方法不當導致的漏檢和誤判。本研究根據《中國藥典》2020 年版四部通則中無菌檢查以及微生物限度檢查的要求 [7],以乳酸環丙沙星原料及其制劑為研究對象,對微生物限度和無菌檢查的方法適應性試驗進行了全面的研究,旨在為藥品的生產和質量檢驗提供可行、有效、安全、可控的依據。
1.材料與儀器
1.1 儀器
本研究使用了 HTY-302G 微生物限度檢測儀(浙江泰林生物技術股份有限公司)、BHC-1300 IIB2 生物安全柜(廣州蘇信環保科技有限公司)、LRH-800生化培養箱(韶關市泰宏醫療器械有限公司)、YXQ-LS-100SII 立式壓力蒸汽滅菌鍋(上海博訊實業有限公司醫療設備廠)、YT-601 集菌儀(杭州盈天科學儀器有限公司)以及層流凈化工作臺(廣州蘇信環保科技有限公司)。
1.2 樣品與試劑
試驗中使用了乳酸環丙沙星原料藥,批號分別為 210810,210709,220109,由浙江國邦藥業有限公司提供;以及乳酸環丙沙星氯化鈉注射液,批號分別為 221202101,221203101,221203102,由廣東大翔制藥有限公司提供。
1.3 試驗用菌種
試驗所用菌種包括金黃色葡萄球菌 CMCC(B)220422、黑曲霉 CMCC(B)220805、白色念珠菌 CMCC(B)220816、銅綠假單胞菌 CMCC(B)220806、大腸埃希菌 CMCC(B)220915、枯草芽孢桿菌 CMCC(B)220402、生孢梭菌CMCC(B)220519,均購自北京三藥科技開發公司。
1.4 培養基
試驗中應用了麥康凱瓊脂培養基(批號:07221101)、胰酪大豆胨瓊脂培養基(TSA,批號:02221103)、麥康凱液體培養基(批號:06221101)、胰 酪 大 豆 胨 液 體 培 養 基( 批 號:02221101)、沙氏葡萄糖瓊脂培養基(SDA,批號:04221101)[8]、硫乙醇酸鹽流體培養基(批號:03221103),這些均購自北京三藥科技開發公司;pH 7.0 氯化鈉 - 蛋白胨緩沖液(批號:140424)以及含 0.2 mol 氯化鎂的 0.1%無菌蛋白胨水溶液(批號:28221203)為實驗室自配。
2.方 法
2.1 菌液制備
使用 0.9% 無菌氯化鈉溶液將金黃色葡萄球菌工作菌株稀釋至不超過100 cfu/mL 的菌懸液,生孢梭菌、大腸埃希菌、銅綠假單胞菌、枯草芽孢桿菌、黑曲霉、白色念珠菌的制備方法相同 [9]。
2.2 微生物限度檢查用供試液的制備
稱取 10 g 乳酸環丙沙星原料藥,用緩沖液稀釋至 100 mL,振搖后靜置,取上清液 10 mL,再次加入緩沖液至100 mL,制備成 1:100 的供試液,振搖后靜置,取上清液進行檢測。
2.3 計數方法適用性試驗
2.3.1 試驗組
需氧菌組:用緩沖液潤濕濾膜,吸取供試液 1 mL 進行薄膜過濾,用緩沖液沖洗 5 次,每次沖洗量為 100 mL,最后一次沖洗液中加入 1 mL 金黃色葡萄球菌試驗菌的菌懸液,過濾后取下濾膜,貼在胰酪大豆胨瓊脂培養基(TSA)中,進行平行試驗 2 份 [10] :枯草芽孢桿菌、銅綠假單胞菌、白色念珠菌和黑曲霉的處理方法相同。需氧菌的平皿在30 ~ 35 ℃環境中培養不超過 3 天;霉菌和酵母菌在 30 ~ 35 ℃的環境中培養不超過 5 天。按薄膜過濾法測定菌數,并取平均值。3 批樣品分別進行試驗。
霉菌和酵母菌組:采用薄膜過濾法進行檢驗,操作與需氧菌組相同,最后一次沖洗液中加入 1 mL 白色念珠菌試驗菌的菌懸液,過濾后取下濾膜貼于沙氏葡萄糖瓊脂(SDA)中,進行平行試驗 2 份;黑曲霉的處理方法相同。將以上平皿放置在 20 ~ 25 ℃環境中培養不超過 5 天,按薄膜過濾法測定菌數,并取平均值。3 批樣品分別進行試驗。
2.3.2 供試品對照組
取“2.2”項下制備好的供試液,用 0.9% 無菌氯化鈉稀釋液代替菌液,其他操作與“2.3.1”項下相同。
2.3.3 菌液對照組
取稀釋液代替供試液,其他操作與“2.3.1”項下相同。
2.3.4 計算菌液對照組
回收率比值分別按下列公式進行計算。

2.4 控制菌檢查方法適用性試驗
2.4.1 試驗組
與需氧菌同樣采用薄膜過濾法檢驗,最后一次沖洗液中加入 1 mL 大腸埃希菌試驗菌的菌懸液,將濾膜轉移到 100 mL 胰酪大豆胨液體培養基上,30 ~ 35 ℃環境中培養 18 h ;取上述 1 mL 培養液接種到 100 mL 麥康凱液體培養基中,42 ~ 44 ℃環境中培養24 h ;將麥康凱液體的培養物進行劃線接種在麥康凱瓊脂培養基的平板上,30 ~ 35 ℃環境中培養 18 h[11]。3 批樣品分別進行試驗。
2.4.2 陽性對照組
取小于 100 cfu 大腸埃希菌菌液,依法按薄膜過濾法檢查,每次沖洗量為 100 mL,沖洗次數為 5 次,將濾膜轉至 100 mL 胰酪大豆胨液體培養基中,其他操作與試驗組相同。
2.4.3 陰性對照組
取胰酪大豆胨液體培養基 100 mL,30 ~ 35 ℃環境中培養 18 h ;其他操作與相應控制菌試驗組相同。
2.5 乳酸環丙沙星氯化鈉注射液無菌方法適用性試驗
2.5.1 試驗組
取一次性使用全封閉式集菌培養器,過濾常規檢驗量的乳酸環丙沙星氯化鈉注射液作為供試品組,用含 0.2 mol/L氯化鎂的 0.1% 無菌蛋白胨水溶液進行沖洗過濾 8 次,注入 100 mL 硫乙醇酸鹽流體培養基,再加入 0.2 mol/L 無菌氯化鎂溶液 5 mL,接入金黃色葡萄球菌懸液 1 mL[12]。大腸埃希菌、生孢梭菌均同法操作。將以上培養基置于33 ℃的條件下培養 5 天;同法操作,白色念珠菌、黑曲霉、枯草芽孢桿菌則注入 100 mL 胰酪大豆胨液體培養基后分別加入菌液 1 mL,將培養器置 23 ℃的條件下培養 5 天,逐日觀察記錄結果 [13]。3 批樣品分別進行試驗。
2.5.2 陽性對照組
取裝有相同體積培養基的容器,加入 0.2 mol/L 無菌氯化鎂溶液 5 mL,再接入等量的試驗菌作為對照。6 種試驗菌分別進行無菌方法適用性試驗,放置在規定的溫度中培養 5 天,每日觀察,記錄結果 [13]。
2.5.3 陰性對照組
以含 0.2 molL 氯化鎂的 0.1% 無菌蛋白胨水溶液代替供試品,分別在過濾后向集菌培養器注入硫乙醇酸鹽流體培養基和胰酪大豆胨液體培養基,再分別加入 0.2 mol/L 無菌氯化鎂溶液 5 mL作為陰性對照。
3.結 果
3.1 乳酸環丙沙星需氧菌總數、霉菌和酵母菌總數計數驗證結果
經過對 3 批乳酸環丙沙星原料藥的計算分析,結果顯示 5 種試驗菌株的回收率比值均在 0.5 ~ 2 的范圍內,這表明所采用的供試液制備方法和計數方法適用于乳酸環丙沙星原料藥的微生物計數。詳細結果參見表1。
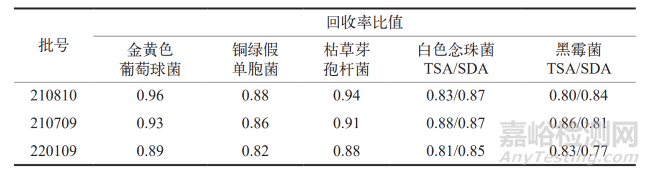
表1 各驗證菌的回收率
3.2 乳酸環丙沙星大腸埃希菌驗證結果
表 2 顯示,在 3 批乳酸環丙沙星樣品的陰性對照組中未檢出大腸埃希菌,而試驗組與陽性對照組中均檢出大腸埃希菌。因此,可以采用本方法對乳酸環丙沙星原料藥進行大腸埃希菌的檢查。表 2 中“+”表示培養液渾濁,有菌生長,“-”表示培養液澄清,無菌生長,后續表格中相同。

表2 大腸埃希菌驗證結果
3.3 乳酸環丙沙星氯化鈉注射液無菌驗證結果
通過表 3 的驗證結果,對 3 個批次的乳酸環丙沙星氯化鈉注射液樣品進行薄膜過濾法過濾后,所有試驗菌均在規定時間內生長良好。與對照組相比,供試品組菌液濁度無明顯差異,生長狀況良好,因此可以使用此方法進行無菌試驗。這表明在該條件下乳酸環丙沙星氯化鈉注射液無抑菌作用,該方法適用于乳酸環丙沙星氯化鈉注射液無菌檢查。

表3 無菌驗證結果
4.討 論
注射用乳酸環丙沙星是一種廣譜抗菌劑,也是較早投入臨床應用的喹諾酮類藥物之一,尤其對需氧革蘭氏陰性菌感染表現出良好的療效。由于其價格低廉且療效顯著,因此在臨床實踐中得到了廣泛的應用。本文按照《中國藥典》2020 年版的四部通則,確定了乳酸環丙沙星原料藥的微生物限度檢查方法以及乳酸環丙沙星氯化鈉注射劑的無菌檢查方法。乳酸環丙沙星及其制劑具有一定的抑菌性,通過薄膜過濾法可以有效去除藥物的抑菌性,從而提高檢驗的效率與準確性 [14-15]。
在試驗過程中發現,采用 1 :100稀釋級的乳酸環丙沙星供試液,以pH7.0 無菌氯化鈉 - 蛋白胨緩沖液作為稀釋液和沖洗液,試驗菌株回收率可以達到 50% ~ 200% 的要求,因此,可以使用此方法對乳酸環丙沙星原料藥進行微生物學限度檢查。為了去除其制劑的抑菌性,采用了含 0.2 mol/L 氯化鎂的 0.1% 無菌蛋白胨水溶液進行沖洗,并加入 0.2 mol/L 無菌氯化鎂溶液5 mL。試驗結果表明,通過該方法可以中和其抑菌作用,因此可以使用此檢查方法對乳酸環丙沙星氯化鈉注射液進行無菌檢查。
參考文獻
[1] 劉露 . 哌拉西林鈉他唑巴坦鈉聯合乳酸環丙沙星治療支氣管擴張癥伴銅綠假單胞菌感染患者的臨床效果 [J]. 中國藥物經濟學,2021,16(08):66-69.
[2] 蕭抒蓉,李世良 . 頭孢哌酮 / 舒巴坦與環丙沙星治療老年支氣管擴張急性加重臨床比較 [J]. 北方藥學,2018,15(2):121-121.
[3] 林國權,呂竹芬,徐潔媚,等 . 乳酸環丙沙星的制備 [J]. 中國醫藥工業雜志,1993(11):484-485.
[4] 彭昌 . 環丙沙星聯合支氣管肺泡灌洗治療老年支氣管擴張感染療效觀察[J].深圳中西醫結合雜志,2017,27(21):88-89.
[5] 胡亞英,馬欣,陳睿,等 . 復黃片微生物限度檢查方法適用性探究 [J]. 中成藥,2020,42(03):788-791.
[6] 韋倩,邱瓊華,李雋永,等 . 散結粉微生物限度檢查方法學研究[J]. 工業微生物,2024,54(05):51-55.
[7] 國家藥典委員會 . 中華人民共和國藥典 [M].4 部 . 北京:中國醫藥科技出版社,2020:162-164.
[8] 唐菱,侯曉軍,周劍,等 . 硫酸新霉素凝膠微生物限度檢查方法的適用性試驗 [J]. 中國抗生素雜志,2016,41(09):680-683.
[9] 符少茹,杜代妹 . 注射用 rhCNB無菌檢查方法學研究 [J]. 健康之路,2017,16(05):256.
[10] 王振偉,孫亦粉,李海倫,等 . 呋鋅軟膏的微生物限度檢查適用性考察 [J]. 按 摩 與 康 復 醫 學,2022,13(24):63-66.
[11] 史銀基,漆也,馬海紅,等 . 藥用復合膜微生物限度檢查方法的建立 [J]. 新疆中醫藥,2016,34(04):48-51.
[12] 肖建光,歐國棟,賴珊,等 . 注射用頭孢尼西鈉無菌檢查方法的優化及關鍵影響因素 [J]. 中國抗生 素 雜 志,2021,46(04):287-290.
[13] 李冬梅,王鈺寧,劉永利,等 . 唑來膦酸及其制劑的微生物學檢查方法研究[J].中國現代應用藥學,2017,34(07):1021-1024.
[14] 余為 . 薄膜過濾法在藥品檢驗中的應用探討 [J]. 世界最新醫學信息文摘,2019,19(60):262.
[15] 陳潔,周劍. 鹽酸小檗堿片微生物限度適用性試驗驗證 [J]. 現代醫 藥 衛 生,2017,33(12):1775-1778.
本文作者梁思華,廣東大翔制藥有限公司,僅供交流學習。

來源:Internet


