您當前的位置:檢測資訊 > 實驗管理
嘉峪檢測網 2025-03-20 08:24
1. 實驗原理
考馬斯亮藍染色是一種常用的蛋白質檢測方法,其原理基于考馬斯亮藍(如R-250和G-250)與蛋白質分子的結合。
當染料與蛋白質結合時,其分子構象發生改變,形成藍色復合物并富集于蛋白質表面的疏水區域,凝膠中原本透明的蛋白質條帶因染料聚集而顯現藍色。
這一顯色機制主要由染料磺酸基團與蛋白質堿性氨基酸殘基(如精氨酸、賴氨酸)之間的靜電引力驅動,同時伴隨范德華力和疏水相互作用的協同效應。
顯色強度與靶蛋白中堿性氨基酸的豐度及染料結合效率密切相關。
圖片來源:https://images.app.goo.gl/iswfooKkfNQNZrK78
考馬斯亮藍分為G-250和R-250兩類。
G-250在游離狀態下呈紅色,最大吸收波長為465 nm;與蛋白質結合后轉變為藍色,復合物的最大吸收峰移至595 nm,且吸光度與蛋白質濃度成正比。由于結合迅速,G-250常用于溶液中的蛋白質定量(如Bradford法)。
R-250與蛋白質結合速度較慢,但可通過甲醇-乙酸溶液去除未結合的染料(脫色步驟),因此更適用于電泳凝膠中蛋白質條帶的染色。
2. 實驗材料
耗材:SDS-PAGE凝膠、染色槽
試劑:
考馬斯亮藍R250染色液:稱取0.25 g考馬斯亮藍R250,加入45 mL甲醇和10 mL冰醋酸,用超純水補足至100 mL,充分混勻。
脫色液:取250 mL甲醇與80 mL冰醋酸混合,再用超純水定容至1000 mL,混合均勻后備用。
ddH2O
設備:搖床、電泳儀
3. 實驗步驟
3.1 電泳
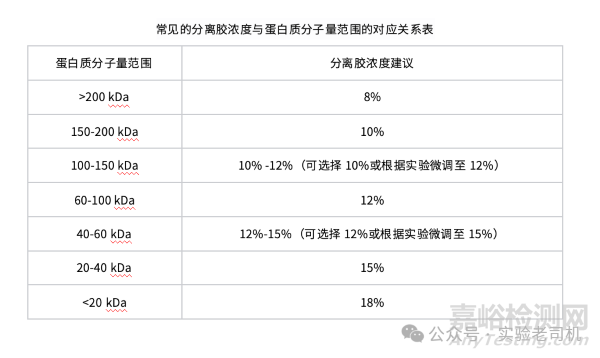
通過SDS-PAGE電泳來分離蛋白質,在這個過程中,要按照蛋白質的大小和其所帶電荷的狀況,選擇濃度適宜的凝膠(小分子用濃度大的,大分子用濃度小的)。
3.2 染色
電泳結束后,將凝膠取出,用水沖洗干凈。隨后加入考馬斯亮藍染色液完全浸沒,并在室溫下搖床染色約30 min或更長,轉速為50-150r/min,具體時間可依據凝膠厚度和實驗條件調整,直至顏色接近染液。
3.3 去染
染色結束后,棄去或回收染色液(一般可重復使用2-3次)。隨后進行脫色處理,一般脫色時間為2-3 h,期間需更換脫色液,直至藍色背景基本上全部被脫去,并且蛋白條帶清晰可見。如需背景更低的凝膠,則需用純水浸泡過夜。
3.4 拍照和分析結果
脫色完畢后應盡快拍照,防止凝膠上蛋白和染料的流失。
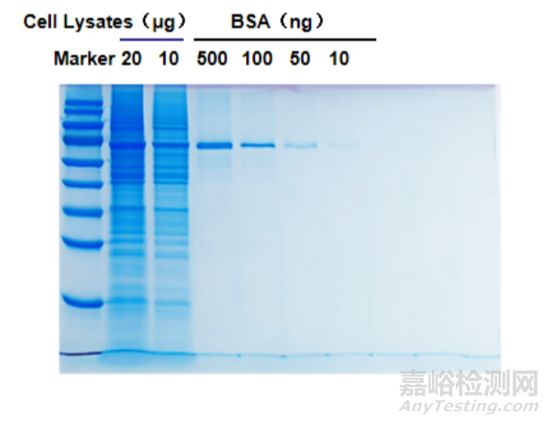
如圖所示為考馬斯亮藍染色的結果圖:按照從左到右的順序,在電泳實驗中依次加入上樣量為20 μg和10 μg的Hela細胞裂解液,以及上樣量為500 ng、100 ng、50 ng、10 ng的BSA純化蛋白的考馬斯亮藍染色后的膠圖。
BSA純化蛋白組為陽性對照,可進一步評估蛋白分離效果,因為BSA純化蛋白的分子量相對明確且單一,在電泳過程中會根據其分子量大小在凝膠中遷移到特定位置。
圖片來源于:https://bio.vazyme.com/products_7/28.html
4. 注意事項
染色時間取決于凝膠厚度和溫度。較厚的凝膠或較低溫度需延長時間,較薄的凝膠或較高溫度則可縮短。一般當凝膠顏色接近染液且難以分辨時,說明染色已完成。適當延長至2~4 h或更久,不會影響最終效果。
脫色完成后,可將凝膠浸泡在水中以備拍照或其他后續操作。但長期浸泡可能導致凝膠溶漲,若需避免,可存放于20%甘油溶液中。此外,凝膠也可制備成干膠以便長期保存。
在蛋白免疫印跡技術體系中,考馬斯亮藍與麗春紅作為互補性染色劑被廣泛應用于不同檢測階段,考馬斯亮藍G-250染色液可達成以下三個目的:
驗證電泳參數有效性(如電流設置、膠體濃度匹配度);
評估轉膜完整性(未轉出蛋白在凝膠對應分子量位置仍殘留可見條帶);
純化蛋白實驗時檢測目的蛋白是否被純化出來。
與之形成對比的是,麗春紅憑借其可逆結合特性,常被用于短暫染色PVDF/NC膜,通過肉眼觀察紅色條帶分布既可快速判斷轉膜均勻性,又能在BSA封閉液處理前通過脫色緩沖液(TBS-T)完全去除染料,避免干擾后續抗體結合。

來源:實驗老司機小米


