您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2019-12-25 15:15
前言
美國藥典(USP)將增加一個新的通則<1236>Solubility Measurements。這一新的章節概述了與溶解度測定相關的概念和方程,還簡要介紹了用于評估藥物溶解度的典型實驗方法,并討論了溶解度的測定方法,以獲得生物相關的用于人和獸藥產品的特定物種的溶解度。
USP<1236>溶解度的測定
一種物質在另一種物質中的溶解度是熱力學平衡中兩種純物質之間分子混合程度的量度。飽和溶液的組成,用在指定溶劑中的指定溶質的比例來表示,代表了溶解度的熱力學極限。溶解度可以用質量摩爾濃度、摩爾分數、摩爾比、重量/體積比、重量/重量比等濃度單位表示。準確測定藥物的水溶性對于理解藥物制劑的質量控制和藥物傳遞問題是非常重要的,受藥物物理化學性質(例如表面積、顆粒大小、晶型)、介質的性質(例如pH、極性、表面張力、添加表面活性劑、助溶劑、鹽)、以及溶解度測定參數的控制(例如溫度、時間、攪拌法)等因素的影響。在溶解度測定中控制這些因素是獲得準確、可靠的物質平衡溶解度的關鍵。
本章將首先討論與溶解度測定有關的概念和方程。理解這些關系是準確評估溶解度的基礎。接下來將簡要介紹用于評估藥物溶解度的典型實驗方法。最后,討論了溶解度測量以獲得生物相關的溶解度(人用產品)和物種依賴性溶解度(獸用產品)。
背景
熱力學平衡與溶解度
混合吉布斯自由能,ΔGmix,決定了兩個化合物混合形成溶液的可能性和程度。
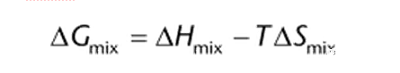
其中,ΔHmix是混合焓,表明混合是吸熱還是放熱過程,T是熱力學溫度,開爾文;ΔSmix是混合熵,是純系統的混亂程度的度量。如果吉布斯自由能的變化是負的,混合將是自發的,當達到平衡時,ΔG等于零。
混合焓ΔHmix,是溶質的焓和溶劑的焓之和與混合物焓間的差值,即:

其中u是溶質,v是溶劑。如果焓變是負的,混合將放熱,反映出附著力作用比內聚力作用更強,有利于混合。一個理想的系統,ΔHmix是零,因為理想的溶質和溶劑之間的相互作用是相同的。因此,對于一個理想的系統:

其中Xu是以摩爾分數表示的溶質濃度,R是氣體常數。當一個結晶固體與飽和溶液處于平衡狀態時,固體和飽和溶液的吉布斯自由能是相等的。同樣,溶液的吉布斯自由能可以認為是理想溶劑和理想溶質液體混合的結果,因此:
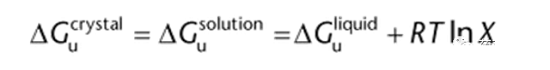
根據Kirchhoff’s定律,不可逆過程的能量等于一系列可逆過程的能量。因此,固體的溶解過程相當于將固體加熱到熔點,然后將液體溶質與溶劑混合,最后將溶液冷卻下來。利用Kirchhoff’s定律和上述方程,可以描述為(1):
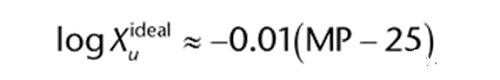
Xu是理想溶質在25℃下的摩爾分數,MP是結晶固體的熔點(℃)。這個方程式說明了結晶固體的熔點與摩爾溶解度的關系。熔點較高的晶體化合物具有較高的內聚力,必須克服,才能將其轉化為液體,才可與溶劑混合,作為理想的溶質。
水溶解中溶解度的估算方法
Yalkowsky證明了(1、2)一個相對簡單的一般溶解度方程(GSE)可以用于估算化合物在水中的固有溶解度。

其中S0是內在的溶解度(未解離分子),MP是結晶固體的熔點(℃),KOW是正辛醇-水分配系數,水溫度25℃。一般溶解度方程表明,具有較高熔點的化合物以及具有較高親油性的化合物的水溶性將降低。一般溶解度方程中正辛醇-水分配系數的對數說明了理想溶液和水溶液混合焓的不同(2)。如果pKa是已知的,一般溶解度方程也可以與Henderson-Hasselbalch方程相結合用來預測離子化合物的溶解度(見影響溶解度和溶解度測定的影響因素,pH值)。
盡管一般溶解度方程很簡單,但使用它時需要測量熔點和分配系數(或離子化合物的pKa)。有幾種計算機軟件用于基于結構的化合物(3)的分配系數和pKa值的估算,但熔點不能。開發來預測水溶液的計算方法依賴于分子的訓練集,以尋找與結構(例如,分子量、溶劑可及表面積、可旋轉的鍵的數量等)(3)。這些計算方法的成功往往局限于類似訓練集的分子。這些計算方法足以在預篩選合成候選者中提供幫助,但不足以取代實驗溶解度測定。
影響溶解度和溶解度測定的因素
pH值的影響
離子化的酸和堿的溶解度是pH依賴性的,因為帶電部分具有較高的水溶性。Henderson–Hasselbalch方程將溶解度的增加與溶液pH值相對于電離酸或堿的pKa或pKb聯系起來。

[HA]是未離解弱酸的摩爾濃度,[A-]是酸的的共軛堿的摩爾濃度,pKa=-log(Ka),Ka是酸離解常數。
分子在pH值低于5.6和高于11.7時電離,在這兩個pH值之間時呈中性。分子沒有離子化時,溶解度等于固有溶解度。對于離子化分子,隨著pH值的變化,溶解度呈對數增加。成鹽后將限制在較低或較高pH值下的溶解度(見圖1)。如果用來調節pH值的酸有助于增加鹽的反離子,那么同離子效應會隨著這個反離子濃度的增加而進一步抑制鹽的溶解度(見圖1)。如果鹽在較高pH值下溶解,最初鹽可能會過飽和,但最終將會在這個pH下因為溶解度小而形成沉淀(4)。

圖1:pH對離子化合物溶解度的影響。當分子沒有離子化時,溶解度相當于固有溶解度。對于電離分子,隨著pH值的變化,溶解度呈對數增加。鹽的溶解度限制了低pH值下的溶解度,如果用于調節pH值的酸對鹽的反離子有一定貢獻,那么,同離子效應會隨著這個反離子濃度的增加而抑制鹽的溶解度(圖中pH值<2)。
鹽和反離子的影響
可電離的化合物也可以用相反的帶電離子(4)來形成鹽。在溶液中,在帶電的反離子存在的情況下,帶電分子的溶解度由溶解度積給出,描述這個平衡反應的方程如下:

鹽在溶液中有限的溶解度如圖1所示。由于鹽的形成,帶電分子的實際溶解度被認為是穩定的(在低pH值時),而不是像Henderson-Hasselbalch方程所預測的那樣繼續增加。因為溶度積,KSP,是一個常數,離子化基團的溶解度可能會隨著調節pH值的帶相反電荷的反離子濃度增加而下降。隨著離子對濃度的增加帶電分子的溶解度降低的現象稱為同離子效應(4)。經常看到,當氯化氫(HCl)用來降低pH值時,氯鹽的溶解度會由于氯濃度的增加而降低(如在pH<2)。雖然在圖1中沒有說明,鹽的溶解度也可能在曲線的堿一側(例如酸部分的鈉鹽)受到限制,高pH值時,同離子效應同樣會影響到鹽的溶解度(例如氫氧化鈉)。
潛溶劑的影響
對于許多藥物,水通常是一個溶解性差的溶劑。但水與其他溶劑可混溶,這些溶劑可為這些物質提供良好的溶解性(如乙醇、丙二醇、聚乙二醇等)。根據對數-線性模型(1),在兩個混合溶劑中,溶質的對數可以通過線性方程進行表示。這種關系如圖2所示。當溶解度曲線被轉換成線性時,很明顯,即使是混合溶劑中的低濃度的溶劑(通常是水),也可以大大降低溶質的溶解度。因此,由于溶解度發生顯著變化,含有潛溶劑的溶液在稀釋時藥物特別容易發生沉淀。
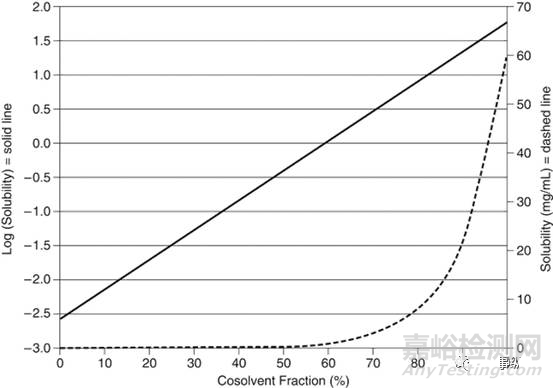
圖2:Yalkowsky等人的對數-線性模型的說明(1)。溶解度的對數與潛溶劑體積分數呈線性關系。當用線性繪制時,很明顯,溶解度隨著加入到溶解性好的溶劑中的溶解性差的溶劑的增加呈指數形式下降。
表面活性劑的影響
在臨界膠束濃度(CMC)之上,溶液中膠束的數量會隨著表面活性劑濃度的增加線性增加。如果一種藥物可以嵌入在膠束中,其溶解度將隨著膠束數量的增加而線性增加(見圖3)。
如圖3所示,表面活性劑存在下的溶解度是水相中溶解的量加上膠束溶解的量。膠束比溶質更大,擴散速度比溶質更慢。在膠束的存在下的藥物的傳遞是由于在溶液中吸收了游離的藥物,以及由微粒子介導的轉運(5,6)。因此,通過表面活性劑的溶解可能不會導致與水溶性的增加直接成正比的藥物傳遞的增強(5、6)。

圖3:通過表面活性劑使溶解度增加。溶解需要膠束的形成。在CMC以下增加表面活性劑,會使表面活性劑在溶劑中溶解,沒有發生溶解度增加。在CMC之上,溶解度呈線性增加。這種線性增加的斜率表明膠束的溶解效率。
絡合劑的影響
絡合劑可與低溶解度物質形成絡合物,從而提高其溶解度。不管配體和溶質在這些絡合物中的比例如何(例如,1:1、2:1、3:1等等),隨著絡合劑濃度的增加,溶解度將呈線性增加(7)。這與表面活性劑的溶解度非常相似,但不存在所需的絡合劑的最小濃度。具有高穩定性常數的絡合物可以緊密結合溶質,從而提高溶液穩定性。環糊精常被用來與藥物形成絡合物來提高溶解度,但是環糊精是非常親水的,具有很高的分子量(大于970g/mol),并且不容易滲透到組織中(7)。因此,強結合的環糊精絡合物可能會延緩藥物的傳遞,因為只有未結合的藥物才能穿透組織(7)。
表面積的影響(溶解速率)
Noyes–Whitney方程為:

D是溶質的擴散系數,A是溶質粒子的表面積,h是擴散層的厚度,Cs是溶質的飽和溶解度,C是t時間溶質的濃度。對于小顆粒,擴散層厚度h,通常認為等于粒子半徑(=½d)。對于球形顆粒,表面積A,可以表示為一個總質量M的函數,密度ρ,粒徑d。
物質的溶解速率不會影響平衡溶解度,但會影響達到平衡的速度。這個方程表明,較小的粒子會有更大的表面積,并且會更快地溶解。為了盡可能快地達到平衡溶解度,應盡可能地保持大的表面積(例如更小的粒子)和盡可能小的擴散層厚度(例如良好的混合)(8)。

來源:Mzwinsunny藥事縱橫


