藥用輔料系指生產藥品和調配處方時使用的賦形劑和附加劑。是除活性成分或前體以外,在安全性方面已進行合理的評估,一般包含在藥物制劑中的物質[1]。
藥品的細菌內毒素檢查是確保藥品安全的重要檢查項目,細菌內毒素不符合規定的藥品在臨床應用時可能產生熱原反應而造成嚴重的不良反應。對藥用輔料進行細菌內毒素控制的目的是為了保障藥品制劑中所含致熱物質符合規定。來源于革蘭陰性細菌細胞壁的細菌內毒素是藥品中最主要的致熱物質,即便是細菌已經死亡,細菌內毒素可能在細胞壁碎片中 保 持 活 性[2-3]。由于細菌內毒素性質穩定[4],在生產工藝中很難清除。因此,確保藥品細菌內毒素符合規定最有效的手段就是源頭控制各種原輔料、包材等細菌內毒素污染在可以接受的范圍內。
基于風險管理的理念,根據藥品安全性的需求,應科學、合理地在藥用輔料標準中設立細菌內毒素檢查項及限度。本研究對現有藥用輔料細菌內毒素控制和標準制定存在的問題進行了分析,對藥用輔料細菌內毒素標準設定、限值計算、生產過程中藥用輔料細菌內毒素控制策略等進行了探討,并對如何收載藥用輔料細菌內毒素檢查項提出了建議。本研究提出了藥用輔料細菌內毒素質量控制和標準研究的指導性意見和規范性要求,對原料藥、藥用輔料的細菌內毒素和熱原控制均有參考意義和實際應用價值。希望能為我國原輔包與制劑關聯審評審批制度下,進一步完善藥用輔料標準體系提供幫助。
1、 各國藥典藥用輔料細菌內毒素檢查現狀
1. 1 《中國藥典》通用技術要求中的有關規定
2020 年版《中國藥典》通則 0251《藥用輔料》中規定用于靜脈用注射劑、沖洗劑等的藥用輔料按細菌內毒素檢查法或熱原檢查法檢查應符合規定[1],在通則 0102《注射劑》和 0128《沖洗劑》中將細菌內毒素或熱原列為一般應檢查的項目[1],由此可見用于靜脈用注射劑、沖洗劑等的藥用輔料的細菌內毒素控制的重要性。
2020 年版《中國藥典》通則 1143 和 1142 收載了細菌內毒素檢查法和熱原檢查法,對檢驗方法提出了具體要求[1]。指導原則 9251《細菌內毒素檢查法應用指導原則》,對于細菌內毒素限值設定、檢查方法選擇、樣品處理等進行了進一步說明[1]。指導原則 9301《注射劑安全性檢查法應用指導原則》中,對于細菌內毒素、熱原檢查項目的設定提供了一般參考要求,并特別指出“注射劑用輔料使用面廣、用量大、來源復雜,與藥品的安全性直接相關。在其質量控制中,應根據藥用輔料的來源、性質、用途、用法用量,配合理化分析方法,設立必要的安全性檢查項目”[1]。
上述標準中,除注射劑安全性檢查法應用指導原則對于注射劑用輔料提出了設立必要的安全性檢查項目的原則要求,均未對藥用輔料內毒素、熱原控制提出具體可操作性的指導要求。
1. 2 《中國藥典》藥用輔料標準中的收載情況
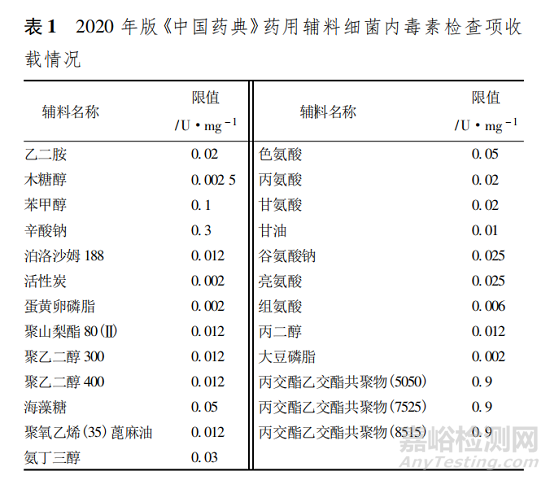
目前,藥用輔料標準大致有以下形式: 《中國藥典》收載的藥用輔料標準( 亦稱品種正文) 、國家藥品監管部門在實行原輔包與制劑關聯審評審批前批準的藥用輔料的注冊標準、藥用輔料生產企業在生產藥用輔料時的內控標準、藥品生產企業為某藥用輔料建立的內控標準、在原輔包登記平臺備案的標準等。2020 年版《中國藥典》有 25 個藥用輔料在品種標準中收載了供注射用藥用輔料的細菌內毒素檢查項,其內毒素限值最小為 0. 002 U·mg - 1,最高為0. 9 U·mg - 1,具體品種和限度見表 1。這些限度的設定參考了國外藥典、注冊標準和部分收集到的企業內控標準等,在實際應用中未必能符合各種制劑生產的需要。
1. 3 《中國藥典》藥用輔料細菌內毒素標準設定
由于藥用輔料在制劑中用途廣泛,用量也千差萬別,這就給藥用輔料是否需要制定細菌內毒素檢查項、如何確定細菌內毒素檢查限值等帶來很大的挑戰。存在的問題: 一是在原輔料與制劑關聯審評審批的政策下,如何更有效的通過控制原輔料的細菌內毒素,以確保制劑最終符合規定。二是藥品生產企業如何針對制劑的需求,正確制定某一藥用輔料細菌內毒素限值,應考慮哪些因素。三是作為通用的基礎性標準的《中國藥典》,藥用輔料細菌內毒素限值一直以單一固定值的方式出現,能否滿足不同制劑的不同需求,可能存在單一固定限值過嚴或者過松的問題。
1. 4 藥用輔料細菌內毒素檢查新進展
一些國際藥品標準中,已經采用了基于風險評估原則的原輔料細菌內毒素污染控制理念。《美國藥典》收載了細菌內毒素檢查法指導原則,認為控制原輔料細菌內毒素污染水平可以最大限度的降低制劑的風險。對于原輔料的細菌內毒素限值計算提出了要求。明確非藥典材料或物品在內部檢測和放行時,應在徹底了解其對制劑的潛在貢獻后分配內毒素限量。從計算出的制劑的內毒素量往回推算,可以為配方中的每一種成分分配限度,并保證如果每種成分達到其限度,不會超 過制劑的限度[5]。
2、 藥用輔料細菌內毒素控制及檢查法設定原則的思考
2. 1 藥用輔料設定細菌內毒素檢查項的原則
對藥用輔料進行細菌內毒素( 或熱原) 檢查,目的是為了保證藥品的細菌內毒素( 或熱原) 檢查符合規定。一般情況下,靜脈用注射劑,椎管內、腹腔、眼內等特殊途徑的注射劑、沖洗液等所用藥用輔料,以及用于其他對細菌內毒素( 熱原) 有控制要求的藥品制劑生產的藥用輔料,應考慮在藥用輔料標準中制定細菌內毒素( 或熱原) 檢查項。
藥用輔料標準是否設立細菌內毒素( 或熱原)檢查項,應基于風險管理的理念,采用“具體問題具體分析”的原則,根據藥用輔料的來源、性質、用途、用法用量等,并結合藥品生產工藝確定。
藥用輔料一般首選細菌內毒素檢查法,部分中藥來源、多組分生化物質、生物技術來源的藥用輔料,或不能排除樣品對細菌內毒素檢查法干擾作用的藥用輔料,可選擇熱原檢查法。
無論《中國藥典》的藥用輔料標準中是否收載細菌內毒素( 或熱原) 檢查項,藥品研究者及上市許可持有人均應在藥品研究和生產中選用能滿足藥品安全性和有效性的藥用輔料,并建立必要的內控標準。
2. 2 基于制劑需求的藥用輔料細菌內毒素檢查限度設定的思路
藥用輔料細菌內毒素限值制定時,應確保制劑中來源于原料、各種藥用輔料及藥包材、生產工藝過程中引入的內毒素總量符合細菌內毒素檢查法( 通則 1143) 的要求。必要時不同輔料可以按照制劑配方比例混合后檢測。藥用輔料用于制劑生產過程中需要進行特殊處理的,應確保處理后的輔料細菌內毒素污染符合制劑生產要求。
藥用輔料的細菌內毒素限值( L) 可參照公式 1確定。
公式中 L 為藥用輔料的細菌內毒素限值,一般以 U·mL - 1、U·mg - 1等表示; R 為藥品制劑生產過程中允許來源于該藥用輔料的細菌內毒素占制劑的細菌內毒素允許總量的比例,可參考該藥用輔料在藥品制劑中的占比,并考慮藥品原料及其他輔料內毒素控制情況,適當從嚴制定。生產過程中藥用輔料的允許內毒素污染量可以根據產品處方工藝、輔料特點等反向指定,并保證每種成分來源的內毒素總量不會超過制劑的內毒素限度; K 取值同通則1143( 細菌內毒素檢查法) ; M 為折合為人每千克體重每小時最大藥品劑量( 簡稱每劑藥品) 中對應的藥用輔料用量。
同一藥用輔料在不同藥品中的用途、用量差異可能較大,因此同一藥用輔料應用于不同的藥品制劑生產時,其內控標準中的細菌內毒素限值可能是不同的。
如經過驗證,藥品制劑生產工藝過程可去除細菌內毒素的,可根據細菌內毒素清除情況,放寬藥用輔料內控標準中細菌內毒素檢查的限值或者不設定細菌內毒素檢查項。
2. 3 制劑生產過程中藥用輔料細菌內毒素控制
通過一個實例,解釋藥用輔料細菌內毒素限值制定的公式,并說明藥品生產企業在實際生產過程中如何控制藥用輔料的細菌內毒素。
公式 1 中 R 值就是允許該部分藥用輔料中的內毒素污染上限占制劑的內毒素污染上限的比例。也就是該部分藥用輔料可以分配的內毒素污染限額。R 值可以參考不同組分在制劑中的質量占比,但這只是其中的一個考慮因素。
例如: 某靜脈注射途徑的藥品 S 的 60 kg 成人每 1 h 最大用量為50 mg,制劑規格為50 mg,產品總質量為 300 mg,其中原料藥( API) 含量為 50 mg,輔料 A 為 100 mg,輔料 B 為 150 mg。
根據細菌內毒素限值的制定要求,60 kg 人靜脈給藥時單次耐受的最大內毒素量為 300 U,因此規格為 50 mg 的制劑內毒素限度為 300 U。制劑內毒素標準為: 取本品,依法檢查,每 1 mg S 中含內毒素的量應小于 6. 0 U。
如果不考慮藥用輔料和生產工藝等因素,原料藥的標準也會定為 6. 0 EU·mg - 1,這樣,所有藥用輔料等將無法制定內毒素標準。引入 R 的概念,就是將產品中內毒素限額合理的分配到制劑的各組分中。假設原料藥和藥用輔料是同等重要的,在不考慮工藝、包材污染等情況下,就是按質量占比分配內毒素限額( 表 2) 。
由表 2 可以看出,計算出來的限度,API 與不同的藥用輔料均相同,各種組分內毒素污染的最大限度和可以保證產品符合規定。實際工作中確定 R 值,不同組分的質量比僅是參考,API 或者不同的藥用輔料對于內毒素污染的貢獻可以是不同的。一般認為 API 是產品中最重要的組分,因此,R 的分配可以多于質量比。各種藥用輔料也可以根據用量、內毒素控制的難易程度等合理分配 R 值。如上例中,如果指定 API 的 R 為 1 /2,則 API 內毒素限值可以是 3. 0 U·mg - 1。那么輔料A 和輔料 B 的 R 值和為 1 /2,按質量比計算分別為1 /5 和3 /10,計算二者內毒素限值均為0. 6 U·mg - 1( 表 3) 。如實際工作中,輔料 A 內毒素無法控制到0. 6 U·mg - 1,只能控制到 1. 0 U·mg - 1,那么可以調整輔料 B 的限值為 0. 33 U·mg - 1。此時,相當于指定 API、輔料 A、輔料 B 的 R 值分別為 1 /2、1 /3、1 /6( 表 4) 。
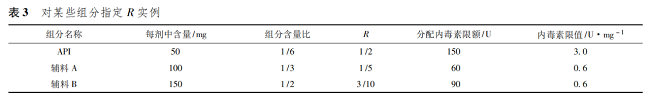

對于一些用量較小或者很難單獨進行細菌內毒素檢測的藥用輔料,可以考慮將不同輔料按照配方的比例混合后進行檢測。如表 3 中情況,可以將輔料 A 和輔料 B 按 2∶ 3 的比例混合后,對混合物進行檢測,限度為 0. 6 U·mg - 1。
實際生產過程中,細菌內毒素限額的分配,除了參考不同組分的細菌內毒素限值外,內毒素實際污染情況也是重要的參考依據。例如,某液體制劑中主要成分實際為注射用水,其 內 毒 素 限 度 為0. 25 U·mL - 1[6],但實際檢測內毒素含量為0. 01 U·mL - 1。如每劑產品中注射用水的用量是250 mL,內毒素分配限額除了可以參考按標準限值計算的125 U外,也可以參考實測值 2. 5 U 進行。但此時一定要基于風險的原則,從嚴考慮。考慮到內毒素檢測方法本身的誤差范圍,至少應采用實測值的 2 ~ 4 倍扣除。由于歷史原因,許多原料藥設定細菌內毒素限值時,并沒有考慮藥用輔料、包材等的使用情況,這種情況下,實際生產時也可以參考原料藥中內毒素污染的實際情況進行控制。
3、 藥用輔料標準中細菌內毒素收載格式的思考
3. 1 《美國藥典》藥用輔料標準中細菌內毒素收載格式
《美國藥典》的國家處方集部分 500 余個藥用輔料標準中僅有 17 個收載了細菌內毒素相關要求,可見《美國藥典》對于藥用輔料細菌內毒素項目設定的基本思路為藥用輔料以滿足制劑生產需要為準。具體分為以下幾種情況。
3. 1. 1 5 個品種規定了檢查項和限值
蔗糖( 用于制備大容量注射液時) 限值為 0. 25 U·mg - 1[7]; 蛋黃卵磷脂限值為 6 U·g - 1[8]; 二甲硅油( 用于注射用物品接觸的涂層) 限值為 10 U·mL - 1[9]; 重組人白蛋白限值為 0. 5 U·mL - 1[10]。
較為特殊的是山梨醇[11],在標準制定時考慮了藥用 輔 料 的 含 量: 當注射劑中山梨醇濃度小于100 g·L - 1時,限值為 46 U·g - 1; 當注射劑中山梨醇濃度大于等于 100 g·L - 1時,限值為 2. 56 U·g - 1。
3. 1. 2 11 個品種列出了檢查項和標示項要求
這些品種基本采取了相同的體例,標準正文中進行了細菌內毒素要求,但不確定限值,而是規定應符合制劑生產的需要,同時要結合標示項的描述。如辛酸[12] ,細菌內毒素: 細菌內毒素含量應符合使用辛酸的相關劑型各論的要求。如果標示中注明在制備注射劑過程中辛酸須經過進一步處理,則( 處理后) 細菌內毒素的含量應符合各論的要求。標示:當辛酸用于注射劑生產時應在標示中注明。
3. 1. 3 1 個品種僅在標示項中提到相關要求[13]
馬來酸標示項中規定,當馬來酸用于注射劑的生產時,應在標示中注明。在注射劑生產過程中,如馬來酸必須經過進一步的處理,以確保細菌內毒素的可接受水平,應在標示中注明。
3. 1. 4 特殊品種在檢查項中描述供試品處理方法
如二甲硅油和殼聚糖[14-15]。其中殼聚糖進行內毒素檢查時供試品處理方式為: 取 0. 5 g 殼聚糖置50 mL 量瓶中,加入細菌內毒素檢查用水和 4. 6 mL1 當量濃度鹽酸,用細菌內毒素檢查用水定容,混勻。在 40 ℃水浴中孵育 48 h 后作為儲備液。試驗時用細菌內毒素檢查用水稀釋 50 倍后檢查( 包括用 β-葡聚糖阻斷劑稀釋 2 倍) 。
3. 2 《歐洲藥典》藥用輔料標準中細菌內毒素收載格式
《歐洲藥典》在編寫體例指導原則中,對于在特定條件下需要進行細菌內毒素檢查的品種給出了體例要求。并且要求可在標示項中注明用于注射劑生產,以 及 細 菌 內 毒 素 限 值。其基本表達方式如下[16-17]。
細菌內毒素: 如用于注射劑生產,且沒有進一步去除內毒素過程的,應小于 2 U·mg - 1。例 2,細菌內毒素: 如果用于注射劑生產,且沒有進一步去除內毒素過程的,如制劑中本品含量小于 100 g·L - 1時,應小 于 4 U · g - 1; 如制劑中本品含量大于等于100 g·L - 1時,應小于 2. 54 U·g - 1。
3. 3 《中國藥典》藥用輔料標準中細菌內毒素收載格式的建議
鑒于《中國藥典》中收載的藥用輔料標準是對該藥用輔料質量控制的基本標準,即便某些藥用輔料會用于需控制細菌內毒素的制劑,直接在《中國藥典》中對其設定單一固定的細菌內毒素限值并不能充分體現嚴謹性。借鑒國外藥典的制定方式,按照《中國藥典》藥用輔料標準的體例格式要求[18],建議藥用輔料標準的細菌內毒素檢查項采用如下原則和方式體現。
3. 3. 1 標準中收載檢查項及限值
對于有安全性控制需要、在制劑中用法用量比較明確且擬定的限度普遍認可的藥用輔料,在《中國藥典》相應藥用輔料標準中收載細菌內毒素檢查項及限值( 例 1) 。某些藥用輔料的細菌內毒素檢查操作較為復雜或特殊,可在檢查項中詳述具體方法( 例 2) 。
例 1: 細菌內毒素( 供注射用)取本品,依法檢查( 通則 1143) ,每 1 mg 樣品中含內毒素的量應小于 0. 012 U。
例 2: 細菌內毒素( 供注射用) 取本品,先加 1%無內毒素的碳酸鈉溶液將供試品溶解并稀釋制成每1 mL 中含 80 mg 的溶液,再用內毒素檢查用水稀釋至所需濃度,依法檢查( 通則1143) ,每1 mg 樣品中含內毒素的量應小于 0. 10 U。
3. 3. 2 標準中收載檢查項不統一規定限值
對于明確需要進行細菌內毒素控制,但限值不宜統一要求的藥用輔料,在《中國藥典》相應藥用輔料標準中將細菌內毒素作為檢查項收載,在標示項以 U 為單位標明每 1 mL( mg 等) 本品中含細菌內毒素的限值或含量( 例 3) 。某些藥用輔料的細菌內毒素檢查操作較為復雜或特殊,可在檢查項中詳述具體方法( 例 4) 。藥品生產企業按照制劑生產需求制定內控標準。
例 3: 細菌內毒素( 供注射用)取本品,依法檢查( 通則 1143) ,每 1 mg 樣品中含內毒素的量應小于標示值。
[標示]應標明每 1 mg 樣品中含內毒素的量應小于的標示值或每 1 mg 樣品中含內毒素的量。
例 4: 細菌內毒素( 供注射用) 取本品,先加 1%無內毒素的碳酸鈉溶液將供試品溶解并稀釋制成每1 mL 中含 80 mg 的溶液,再用內毒素檢查用水稀釋至所需濃度,依法檢查( 通則 1143) ,每 1 mg 樣品中含內毒素的量應小于標示值。
[標示]應標明每 1 mg 樣品中含內毒素的量應小于的標示值或每 1 mg 樣品中含內毒素的量。
《中國藥典》通則 0251 藥用輔料中規定“標示項下規定應標明的內容應在產品標簽、包裝、質量標準或檢驗報告書( 其中至少一個) 中標明”,以便藥用輔料的生產環節和使用環節( 藥品生產企業) 可以進行約定與查驗,第三方( 如監管部門) 也可以進行必要的抽查檢驗。
4、 結語
隨著原輔包與制劑關聯審評審批政策在我國的實施,如何科學合理地制定原料藥、藥用輔料、包材等質量標準,還存在一些亟需解決的問題[19-22]。國家藥典委也在積極推動標準研究適應關聯審評等新要求,致力于建立既符合藥品質量控制的基本要求,又能切實有效指導生產實際的標準研究規則和體系。
本研究從藥用輔料細菌內毒素控制的角度進行了探討,采用了以滿足制劑需求為核心的輔料質量控制理念,這也是被歐美等先進國家所接受的。但標準變化在一定時間內也會給行業帶來一定的挑戰,如輔料生產企業如何能生產出滿足不同制劑生產需求的輔料產品,藥品監管部門如何加強輔料生產的監督管理等。這有待于監管部門與相關企業等共同努力,推動原料藥、藥用輔料和藥品標準的研究更加規范、有效,促進藥品生產企業落實主體責任,確保人民群眾用藥安全。致謝: 高華研究員、唐黎明主任藥師、袁耀佐主任藥師等專家指導和幫助; IPEC 中國、北京藥檢院、天津藥檢院、湖州展望藥業、齊魯制藥等單位提供建議。