摘 要
男性生殖系統用藥的生殖毒性評價具有特殊性��,需要關注雄性生殖毒性風險����,還需關注雄性介導的發育毒性風險�。對于男性生殖系統用藥,需基于其特殊性,具體問題具體分析,綜合受試物的藥理/毒理作用機制、同類藥物信息、組織分布(精液分布)�、適應證特點等因素來開展合適的生殖毒性試驗�����。不同適應證對于生殖毒性風險的接受程度不同,需根據相關試驗結果進行獲益-風險綜合評價,制定相應的風險管控措施,以降低臨床試驗中受試者和臨床應用中患者的生殖毒性風險��。本文闡述了國際人用藥品注冊技術要求協調會和監管機構相關指導原則的相關要求�����,梳理分析已批準上市男性生殖系統用藥的生殖毒性研究情況,并在此基礎上提出了男性生殖系統用藥生殖毒性評價需要關注的要點。
生殖毒性是指外源性物質產生的對生殖細胞����、受孕�����、妊娠����、分娩�����、哺乳等親代生殖機能的不良影響�,以及對子代胚胎-胎仔發育��、出生后發育的不良影響�。雄性生殖系統可能受到外界化學物質的干擾而造成損傷����,包括睪丸、附睪、精子生成和質量以及激素分泌系統等損傷。藥物雄性生殖毒性主要是指藥物對雄性生殖系統(睪丸、附睪等)及生殖功能造成損傷���,一般包括生殖器官器質性改變、精子數量和/或質量下降、性行為改變����、生育力降低�����、性激素分泌異常等,以及通過精子遺傳物質傳遞,和/或精液-陰道攝入而產生的胚胎-胎仔發育毒性�。男性生殖系統用藥作為一類特殊治療領域的藥物,直接作用于男性生殖系統����,部分品種參與內分泌系統的調節和反饋����,而且該類藥物一般用藥周期較長或可能反復用藥��,具有較高的生殖毒性風險��,尤其是雄性生殖毒性風險,因此需重點關注生殖毒性�����。本文闡述了國際人用藥品注冊技術要求協調會( ICH)和藥品監管機構相關指導原則的要求���,并梳理分析了國內外批準上市男性生殖系統用藥的生殖毒性試驗研究情況�����,探討男性生殖系統用藥生殖毒性風險評價的關注要點�����,以期為該類藥物研究與評價提供參考。
1�、男性生殖系統用藥生殖毒性研究的監管要求
1.1ICH指導原則
ICH M3(R2)《支持藥物進行臨床試驗和上市的非臨床安全性研究指導原則》中在第11節中提出了藥物生殖毒性試驗階段性研究的一般性要求�。針對男性用藥人群�����,ICH M3(R2)中指出“因在重復給藥毒性試驗中評價了藥物對生殖器官的影響���,所以在雄性生育力試驗完成前,男性受試者可以入選Ⅰ和Ⅱ期臨床試驗�����。應在大規?�;蜷L期的臨床試驗(如Ⅲ期)開始前完成雄性生育力試驗”����,注釋2提出了重復給藥毒性試驗的雄性動物生殖器官評價的要求為:在期限至少2周的重復給藥毒性試驗(通常為嚙齒類動物)中進行睪丸全面標準組織病理學檢查��?���!禝CH M3問與答》指出“ICH M3(R2)指導原則并未就男性專用藥進行胚胎-胎仔發育試驗給予建議。男性專用藥的胚胎-胎仔發育試驗應遵循具體情況具體分析原則”�,指出“在潛在生殖和發育風險明確之前�����,在男性中采取避孕措施是常規做法”。
ICH S5(R3)《人用藥物生殖與發育毒性檢測指導原則》為支持藥物進行臨床試驗和上市申請所需的非臨床生殖與發育毒性試驗(國內稱為“生殖毒性試驗”)提出了國際協調要求��。其中�����,針對生育力與早期胚胎發育試驗(FEED)的策略�����,指出“當為支持目標人群的暴露需要進行一項FEED試驗時,大多數情況下預期包含交配階段����。這種試驗通常采用嚙齒類動物。如果預期對生育力無不良影響,可以在同一試驗中對2種性別進行給藥和合籠�����。如果該試驗確定了對生育力有影響�����,則應確定受影響的性別���。相反�����,如果根據作用機制或重復給藥毒性試驗的結果預期會有不良影響,則每一給藥的單性別可與未給藥的對應性別進行合籠。這可以在單個試驗中使用單獨的給藥臂來實現,也可以通過進行2個單獨的FEED試驗來實現。對生育力和早期胚胎發育不良影響的可逆性評估,對風險評估具有重要影響”��。
ICH S5(R3)中針對雄性動物FEED試驗設計�����,指出“對雄性嚙齒類動物的FEED試驗設計包括合籠前給藥2~4周����,以使得能檢測對精子生成和附睪運輸的影響��。當重復給藥毒性試驗資料表明藥物對睪丸有毒性時��,延長合籠前給藥時間至10周是合適的,這使得能評估對完整生精周期和附睪運輸的影響。FEED試驗還可檢測功能性影響(例如性欲��、附睪精子成熟�����、射精),而這些功能性影響不能通過雄性生殖器官的組織學檢查來檢測”�����。另外�����,ICH S5(R3)還指出“當基于藥物的作用機制或以往的試驗資料對生育力有擔憂的理由時��,可以在重復給藥毒性試驗和/或生育力試驗中納入額外的檢查(例如,采集精子進行精子計數和形態/活力評估���、測量激素水平或監測動情/月經周期),以進一步描述藥物對生育力的潛在影響”����。
ICH S5(R3)針對生物制品提出特殊考慮�。對于生物制品,若在嚙齒類動物或兔中有藥理學活性,推薦在一種種屬中進行FEED試驗�。在非人靈長類動物(NHP)是唯一的藥理學相關種屬(如對于許多單抗)情況下�����,在給藥期限至少3個月以上的重復給藥毒性試驗中對生殖組織進行組織病理學檢查可作為生育力評估的一種替代方法。這種方法應包括對雌性和雄性動物的生殖器官進行詳細全面的組織病理學檢查,且在試驗開始時動物應達到性成熟(除非該生物制品擬用于治療晚期癌癥)�。ICH S5(R3)在其注釋1中提出了重復給藥毒性試驗中雌雄動物組織病理學檢查的要求�����,其中,對于雄性動物的要求為睪丸和附睪應采用能保存生精上皮組織結構的方法進行取材和處理;對生精周期進行詳細的顯微鏡定性評價是檢測對精子發生影響的靈敏方法��;盡管一般沒有必要����,但在試驗設計中納入附加的試驗終點(例如免疫組織化學�、抗均質化的精子計數、流式細胞術��、分期定量分析)���,可用于進一步表征任何已確證的影響����。
1.2美國指導原則
美國食品藥品監督管理局(FDA)于2018年10月正式發布了《藥物研發過程中睪丸毒性評價指導原則》。該指導原則討論了關于可能對睪丸產生不良影響(睪丸毒性)的藥物的下列主題:①提示藥物臨床睪丸毒性風險的非臨床發現����,以及對評估這種風險的程度而可能需要的非臨床試驗���;②當對男性受試者首次給予這些藥物時�����,可采用的臨床監測;③主要目的為評估藥物相關睪丸毒性的臨床試驗的設計���。
關于非臨床評價方面,FDA認為:雄性生殖系統的非臨床評價是藥物開發過程中非臨床安全性評價的一個標準組成部分�����。動物中對雄性生殖系統的藥物相關毒性結果�����,特別是合適動物種屬的雄性生殖器官中藥物蓄積證據���,確定是否有必要評價藥物對男性的睪丸毒性��。評估睪丸毒性常規采用以下方法:①2種動物種屬給藥2~4周的重復給藥毒性試驗��,除非只有一種藥理學相關動物種屬�;②嚙齒類動物雄性生育力評估(如適用)�����。其他信息可來源于胚胎-胎仔生殖發育毒性試驗以及出生前���、新生仔或幼齡動物暴露后的生育力評估�,另外��,還應考慮已知的藥物類別效應和/或潛在的靶點相關效應�����。該指導原則還提出的非臨床試驗設計時的一些考慮點,詳見指導原則Ⅲ.B節�。
一般來說����,引起對生育力損傷擔憂的雄性動物的生殖毒性結果包括(但不限于):睪丸萎縮����、變性��、壞死或細胞數量過少;生精小管變性或壞死增加����;生殖細胞耗竭�����;或者其他可能提示生殖功能受損的病理學變化���。此外�,在其他相關雄性生殖器官(如前列腺、精囊、附睪)的發現可能提示睪丸毒性。對與生殖功能下降和/或不良組織病理學相關的直接作用的睪丸毒性物質��,申請人應考慮睪丸功能的臨床評估����。
該指導原則中列出了增加雄性生育力擔憂的非臨床研究的10種結果:①發生于臨床相關暴露量或臨床暴露量低倍數時的發現;②發生于多個動物種屬中的發現���。③隨著暴露時間延長發生率和嚴重程度升高的發現;④在末次給藥后1至2個生精周期或5個半衰期后,發現未恢復或僅顯示部分恢復�����;⑤在成對器官中雙側均出現的發現���;⑥在健康未給藥動物中罕見的發現�����;⑦與不良病理學相關的生殖器官重量改變(升高或降低)�;⑧雄性生育力降低和交配行為受損���;⑨精子質量的不良影響(數量�����、活力或形態)��;⑩激素紊亂的表現為抗雄激素表現-雄性性器官重量和成熟降低,包括精囊和前列腺(當其與其分泌物稱重),提示攻擊性降低的臨床癥狀(例如����,嗜睡或交配行為減少,雄性動物雌性化)��,雄激素體征-雌性動物雄性化(生育力降低��,雌性性器官病理����,或動情周期)��,睪丸大小減小�,精子發生受損�����。
該指導原則指出多種因素可混淆明顯的雄性生殖毒性����,包括體質量下降或損傷神經肌肉/神經功能的藥物可能導致與生殖功能受損相符的信號����;當在睪丸組織病理學檢查中檢測到精子發生減少時,記錄動物的生殖年齡并確定藥物對睪丸發育和精子發生是否具有暫時或永久的影響是很重要的��;對大鼠精子質量造成不良影響而不影響交配結果的藥物�����,對人類男性仍然可能是一種風險��,因為這些發現可能表明對睪丸功能的不良影響�����,獨立于交配結果����。對于其作用機制是基于激素水平變化的睪丸毒性藥物,申請人應臨床監測激素�����。
基于對非臨床毒理學試驗結果和任何其他結果的評估���,申請人應基于具體問題具體分析原則�,考慮追加非臨床研究以表征所觀察到的雄性生殖毒性。追加試驗可包括以下評估:證明停藥后毒性發現可恢復的潛力��,若不能從最初的毒理學研究中所獲得�;生殖激素分析,需認識到激素水平在不同動物間和1天內以及試驗過程中可能變異大�;靶細胞類型的確定(例如精子細胞����、睪丸間質細胞����、支持細胞)。在某些情況下���,在重復給藥毒性試驗或生育力試驗中納入生育力和/或精子質量分析可能是合適的。在雄性生育力試驗中����,可以增加交配前的給藥時間�,以覆蓋整個生精周期和附睪運輸(例如��,大鼠約為63 d)���,以確定既往試驗中預期或觀察到的毒性的程度。在毒性結果被懷疑是種屬依賴性時��,在第2種種屬中的確證性試驗是有用的���,例如���,當毒性結果由種屬特異性代謝所致時��。
該指導原則提出了對臨床試驗期間的睪丸監測�����、評價藥物對睪丸影響的臨床試驗設計的要求,其中包括:根據藥物非臨床試驗結果,預測其在臨床相關暴露可能引起人睪丸毒性,應在臨床開發早期即制定人睪丸損傷風險最小化和監測計劃����。對這些要求本文不進行闡述�,具體可參見指導原則��。
總體上����,FDA認為當非臨床試驗顯示對雄性生殖器官�、精液分析和/或生育力有藥物相關的不良影響時,申請人應考慮其對人類的潛在風險;如果需要對男性睪丸毒性進行評估,應在男性受試者的臨床試驗的早期,或在藥物開發的適當階段��,制定闡述和監測睪丸損傷風險的計劃��。
FDA于2015年6月發布了《雄性介導的藥物發育毒性風險評估指導原則(草案)》��。雖然FDA后續未發布該指導原則的正式稿,但其中對于男性生殖系統用藥的發育毒性風險評估的科學性和監管理念仍具有借鑒和參考價值��。該指導原則(草案)總結了FDA對男性人群使用藥物后潛在相關發育毒性風險評估的策略與方法�����,拓展了對傳統雄性生殖與發育毒性的認識與評價。該指導原則(草案)為申請人提供了男性給予活性藥物成分(API)后對胚胎/胎仔發育的風險(無論是通過對男性生殖細胞的影響�,還是妊娠動物或人類給予顯示具有遺傳毒性或強發育毒性的藥物后經精液轉移)評估的建議�����,該指導原則的詳細內容見《FDA〈藥物雄性介導發育毒性風險評估指導原則〉介紹》一文��。
該指導原則指出:男性在其性伴侶妊娠前/后暴露于API可能會導致其女性伴侶的孕體(胚胎-胎仔)遭受發育毒性風險,男性介導的發育毒性來自妊娠(受精)前藥物對精子細胞的損傷或妊娠期間藥物通過精液轉移至妊娠女性體內(陰道攝入)使孕體獲得的直接藥物暴露2個方面。當一項臨床試驗涉及到潛在生殖或發育毒性藥物暴露時,風險特征、知情同意��、避孕措施是重要的考慮點����。研究者在設計包含男性研究對象的臨床試驗時需要考慮男性受試者給藥后對其性伴侶(妊娠或可能妊娠的女性)可能帶來潛在的孕體不良影響。鑒于缺乏臨床信息,非臨床數據將被用于評估風險和為確定關于臨床試驗期間開展適當預防措施的必要性提供信息。該指導原則提出了雄性介導發育毒性風險評估的考慮要點與建議����、與評估藥物引起的雄性介導發育毒性相關的非臨床研究����,也提出臨床風險減控的建議(如當預期有風險時���,避免妊娠或避免通過精液轉移給妊娠的性伴侶)����。
該指導原則指出:評價雄性介導的發育毒性風險以制定風險減控策略,依賴于相關的非臨床和臨床信息的可獲得性。評估藥物雄性介導的潛在發育毒性時應考慮的重要因素包括①藥物或其相關化合物的生殖和發育毒性�����;②藥物的細胞毒性或遺傳毒性����;③提示毒性風險的藥理學作用特征(例如���,該藥是否直接靶向或間接影響發育信號通路�����、快速分裂細胞或內分泌功能)�;④藥物的吸收�����、分布�����、代謝和排泄特征(例如,在雄性生殖器官中的分布和/或蓄積����,或在精液中分布)����?�;谏鲜隹紤]�,FDA會綜合考慮申請人所提供的全面資料��,以支持在臨床試驗設計時給出是否需要男性避孕的建議�����,或支持藥品上市時的說明書建議。
該指導原則提供了一些與評估藥物引起的雄性介導發育毒性相關的非臨床研究的內容����,體外研究包括遺傳毒性標準組合試驗、藥物對精子(如殺精試驗�、多種精子遺傳學完整性試驗)或對胚胎(如胚胎全培養)影響的各種體外試驗����,體內研究包括成熟雄性動物適當的生殖器官組織病理學檢查和/或精子分析的一般毒理學試驗�����、生殖和發育毒性試驗標準組合�����。對于大部分藥物而言����,評價父代介導的發育毒性僅有的標準體內試驗為生育力與早期胚胎發育毒性試驗���,當僅雄性動物給藥時可以進行直接的毒性評價��。一旦發現明顯的發育毒性影響(如著床前后死亡�、早期胚胎畸形)���,則應開展交配前單性別給藥試驗��,以分析雄性和/或雌性動物單獨給藥對毒性影響的貢獻作用�。因標準的生育力與早期胚胎發育毒性試驗不能充分發現全部的潛在發育毒性作用�����,故若雄性單性別給藥與未給藥雌性交配試驗中出現發育毒性信號時��,應該考慮開展追加試驗����,使妊娠動物延長至臨產前再行解剖檢查。此外,對于動物或人類潛在發育毒性物質����,應考慮測定精液中API含量�����,以努力定量推測可能到達孕體(胚胎-胎仔)中的暴露水平。如果雄性介導發育毒性風險不確定或經檢測確定存在,應該對男性研究對象或患者應采取的預防措施類型(如使用避孕套和/或可靠的女性用避孕方法)和時限給予建議���,以保證避免女性伴侶妊娠或孕體暴露。
1.3中國指導原則
國內于2006年11月發布的《藥物生殖毒性研究技術指導原則》主要參考了起草當時執行的ICH S5(R2)指導原則進行制訂,該指導原則對規范和促進我國藥物生殖毒性研究起到了重要作用�。我國于2017年加入ICH后�����,ICH指導原則開始在中國實施,因此藥物生殖毒性試驗研究要求需參考ICH指導原則��,如ICH M3(R2)和2020年新發布的ICH S5(R3)等���,原2006年版《藥物生殖毒性研究技術指導原則》不再適用�����。
2��、男性生殖系統用藥生殖毒性研究情況
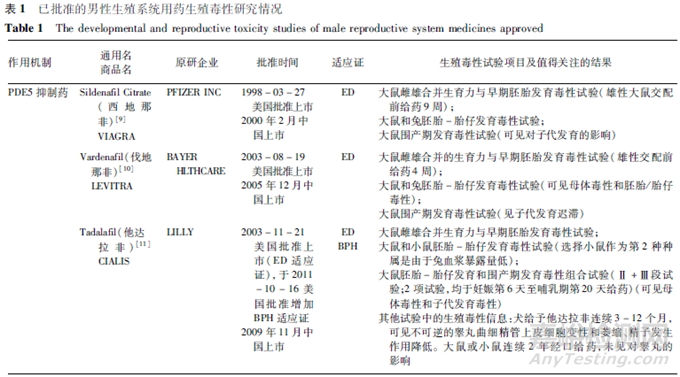
目前獲批上市的男性生殖系統用藥主要集中于治療勃起功能障礙(ED)和良性前列腺增生(BPH)。按作用機制分類,主要包括磷酸二酯酶5抑制藥(PDE5I)����、腎上腺素α1受體拮抗藥����、5α還原酶抑制藥�����。美國批準上市的男性生殖系統新藥中,治療ED的藥物包括西地那非(1998年)����、伐地那非(2003年)�、阿伐那非(2012年)等����,治療BPH的藥物包括特拉唑嗪(1987年)�����、多沙唑嗪(1990年)、坦索羅辛(1997年)、阿夫唑嗪(2003年)�����、多沙唑嗪(1990年)���、賽洛多辛(2008年)�、非那雄胺(1992年)、度他雄胺(2001年)等,獲批治療ED和BPH 2個適應證的藥物有他達拉非(2003年)�����。目前��,國內批準開展臨床試驗的男性生殖系統藥物也主要集中于該2類適應證���。也有其他適應證品種,例如��,用于治療男性早泄的鹽酸達泊西汀片�,其作用機制為抑制5-羥色胺再攝取。另外���,用于前列腺癌的藥物,主要包括去勢治療藥物�、雄激素拮抗藥�、化療藥物�、個體化治療藥物等,由于其屬于抗腫瘤藥物��,其非臨床安全性評價有其特殊性����,本文不對該類藥物進行討論。
根據FDA公開的審評意見����,對已批準上市的主要男性生殖系統用藥的生殖毒性研究情況進行了梳理��,匯總見表1。限于篇幅���,該表僅列出生殖毒性試驗及相關試驗中的主要陽性結果,詳細結果參見相應品種的FDA藥理毒理審評報告和批準的說明書�。
分析表1中的品種�,上市時間跨度時間較長(1987年至2012年)���,總體來說上市時間較早��,因生殖毒性試驗進行時間均早于上市時間����,一部分品種的生殖毒性試驗在ICH S5首次發布之前(首次的《S5A:藥物生殖毒檢測指導原則》和《S5B:指導原則附錄:雄性生育力毒性》分別發布于1993年6月和1995年11月)����,也在ICH M3首次發布之前(首次的M3發布于1997年7月)���,因此��,這些品種的生殖毒性研究伴隨了國際上對生殖毒性試驗的不斷認識和完善過程�����。分析這些品種所進行的生殖毒性試驗對男性生殖系統用藥研發的參考性,應結合其藥物研發具體背景�、品種特點�����,并結合當前國際上對藥物生殖毒性和生殖毒性試驗的認識進行綜合考慮。
分析這些品種所進行的生殖毒性試驗�,上市前均完成了大鼠生育力與早期胚胎發育毒性試驗�����、2種種屬的胚胎-胎仔發育毒性試驗和大鼠圍產期發育毒性試驗��,部分品種基于其試驗結果或者基于藥物所預測的潛在擔憂,進行了追加試驗����。男性生殖系統用藥為單性別用藥��,這些品種采用了大多數藥物生殖毒性評價所采用的三段式試驗設計,推測其主要原因是��,評價藥物潛在的生殖和發育風險需要能夠評價對生殖過程的所有階段�����,若僅進行生育力與早期胚胎發育毒性試驗,僅能評價對生育力和早期胚胎發育的影響,無法評價對雄性生殖系統及生殖功能的影響所致的對子代發育的長期影響���,因而無法闡述由于雄性/男性用藥的全面影響;另外�����,考慮到男性用藥可能存在雄性介導的胚胎-胎仔發育毒性的風險�,即精液轉移將生殖/發育毒性藥物轉移至妊娠性伴侶體內,從而導致胚胎-胎仔發育毒性風險�����,進行胚胎-胎仔發育毒性試驗和圍產期發育毒性試驗��,可以考察藥物在系統暴露情況下對胚胎-胎仔以及子代生長發育的潛在影響���,更好地暴露生殖和發育毒性風險��。對于某些類別的藥物可能用于多種適應證且包括女性患者,如PDE5抑制藥用于肺動脈高壓,α1受體拮抗藥用于高血壓����,從藥物開發的角度獲得全面的生殖毒性試驗信息具有必要性��。而且,藥物上市后,存在妊娠婦女意外暴露的可能��,由于藥物的生殖毒性的嚴重性(如致畸性不可逆)����,從科學性和安全性的角度,識別藥物生殖毒性風險并將相關風險寫入藥品說明書,有助于指導安全用藥�����。但是����,對于男性生殖系統用藥��,尤其是男性專用藥�����,目前,ICH相關指導原則尚未給出具體要求���,應遵循具體情況具體分析原則。
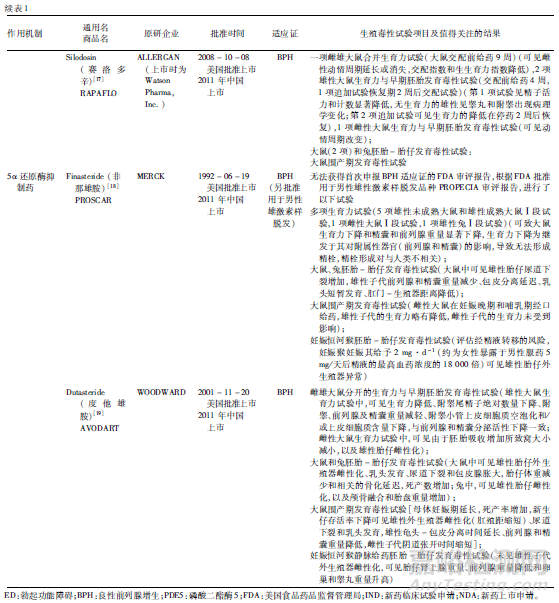
從生育力與早期胚胎發育毒性試驗看�,均進行了雌雄動物生育力試驗�,大多進行了雌雄合并生育力與早期胚胎發育毒性試驗����,可能與試驗進行時間較早而當時對試驗設計的認識有關,但是�,在發現問題時追加進行了單性別生育力(尤其是雄性生育力)試驗�����,有些還進行了恢復期觀察,以考察生育力影響在停藥后是否可恢復����。雄性動物交配前給藥時間方面�,這些品種雄性動物為交配前給藥4周或覆蓋整個生精周期(大于9周),其中PDE5抑制藥除西地那非交配前給藥9周給藥外��,其余均為交配前給藥4周�,α1受體拮抗藥和5α還原酶抑制藥雄性給藥則均覆蓋了整個生精周期。推測原因可能與藥物靶點相關風險有關��,α1受體拮抗藥和5α還原酶抑制藥可能對雄性生殖功能或生育力有損傷作用�����,因此雄性給藥覆蓋了整個生精周期,而且大部分品種進行了恢復期考察��。對于5α還原酶抑制藥����,根據其靶點和作用機制,預期會對雄性生殖系統和生育力產生不良影響���,由于該類藥物抑制睪酮向雙氫睪酮(DHT)的轉化,而DHT是一種雄性外生殖器正常發育必須的性激素�����,DHT缺乏會導致男性嬰兒生殖器的畸形�。
對于此類藥物,還需重點關注雄性介導的胚胎-胎仔發育毒性���。例如度他雄胺,在胚胎-胎仔發育毒性試驗中�,妊娠大鼠于器官發生期給藥�����,在0.05 mg/次/天(比MRHD低10倍)劑量下可見雄性胎仔外生殖器雌性化(肛殖距減少)、乳頭發育��、尿道下裂和包皮腺脹大���,妊娠兔于器官發生期給藥���,也可見雄性胎仔雌性化(外生殖器乳頭組織學評估)��,以及顱骨融合和胎盤重量增加���。此外�����,為研究通過精液轉移至妊娠性伴侶體內導致胚胎-胎仔發育毒性風險��,還開展了妊娠恒河猴靜脈給藥相當于人類精液中度他雄胺濃度的胚胎-胎仔發育毒性試驗����,在試驗劑量下未見雄性胎仔外生殖器發育的明顯異常���,但在最高劑量下可見胎仔腎上腺重量�����、前列腺重量��、卵巢和睪丸重量升高。度他雄胺軟膠囊說明書提示:妊娠或可能妊娠的婦女不應使用度他雄胺。度他雄胺可經皮膚吸收����,可能導致胎兒意外暴露�����,對男性胎兒有潛在風險。如果妊娠婦女接觸到泄漏的膠囊����,應立即用肥皂和清水洗滌接觸部位���。接受度他雄胺治療的男性在服用最后1劑后至少6個月后才可獻血����,這一延遲期的目的是防止接受輸血的孕婦暴露于度他雄胺����。
3、男性生殖系統用藥生殖毒性評價的關注要點
基于上述ICH和各監管機構相關指導原則的相關要求,對已批準上市男性生殖系統用藥的生殖毒性研究情況進行分析,在此基礎上提出了男性生殖系統用藥生殖毒性評價需要關注的要點�。男性生殖系統用藥的作用靶器官為男性生殖系統���,需要關注通過雄性生殖系統的影響(如對精子生產的影響)而產生的生殖和發育毒性��,影響通過精液轉移和陰道攝入轉移至妊娠性伴侶而產生的胚胎-胎仔發育毒性,此外,部分品種的適應證可能涉及生育(如ED)����,更需關注生殖和發育毒性��。下面從生殖毒性評價考慮要點,風險識別和控制方面探討男性生殖系統用藥生殖毒性風險評價的考慮。
3.1男性生殖系統用藥生殖毒性評價的考慮要點
藥物生殖毒性研究最常用的試驗方案是三段式試驗方案,包括生育力與早期胚胎發育毒性試驗(Ⅰ段)�����、胚胎-胎仔發育毒性試驗(Ⅱ段)�、圍產期毒性試驗(Ⅲ段),其中僅Ⅰ段試驗涉及到了雄性生殖毒性評價。另外,重復給藥毒性試驗中對于雄性生殖器官組織病理學檢查也是雄性生殖毒性評價的重要內容。然而��,正如前文所述���,Ⅰ段生殖毒性試驗僅能評價對生育力和早期胚胎發育的影響�,而無法評價因對雄性生殖系統及生殖功能影響所致的對子代發育的長期影響,從而無法闡述雄性/男性用藥所致的全面影響。ICH M3(R2)和ICH S5(R3)等指導原則并未就男性專用藥(包括男性生殖系統用藥)進行Ⅱ段和Ⅲ段生殖毒性試驗給予建議,應遵循具體情況具體分析原則����?���;谀行陨诚到y用藥的特殊性���,應根據藥物的藥理/毒理作用機制�、同類藥物信息����、組織分布(精液分布)、適應證特點等綜合考慮階段性開展生殖毒性試驗并進行風險評估�����。
在重復給藥毒性試驗生殖器官組織病理學檢查方面�����,需要予以高度關注�����,ICH M3(R2)要求的是標準組織病理學檢查,ICH M3(R2)和ICH S5(R3)對組織病理學檢查提出的具體要求見上文“1.1”����。
在Ⅰ段生殖毒性試驗分為2種性別同時給藥和單性別單獨給藥兩類設計�����。對于2種性別同時給藥的Ⅰ段試驗,雌雄2種雙性別動物均給藥后交配��,可伴隨精子分析和組織學檢查���,評價雄性����、雌性生殖性能、生育力和早期胚胎發育毒性�����。此方法的優點在于減少實驗動物使用量����、省時省力,對于雄性生殖器官毒性可以給予一定的評價�����,但是其缺點是如果出現生育力或早期胚胎毒性陽性結果時�����,無法明確毒性作用是由于雄性給藥還是雌性給藥造成的�����,或是兩者的聯合作用。對于單性別單獨給藥的Ⅰ段試驗���,雄性動物給藥后與不給藥的雌性動物交配,雌性動物給藥后與不給藥的雄性動物交配��,可伴隨精子分析和組織學檢查�����,分別評價雄性���、雌性的生殖功能���、生育力及其胚胎毒性影響���。此方法的優點在于可以明確生殖發育毒性中雄性或雌性給藥的作用,直接評價藥物雄性給藥可能產生的生殖和發育毒性。目前國外創新藥大多進行單性別單獨給藥Ⅰ段試驗����,以獲得更多�����、更直接的雄性或雌性生育力與早期胚胎發育毒性信息;而國內申報資料中的Ⅰ段試驗目前仍大多采用2種性別同時給藥。
2020年發布的ICH S5(R3)反映了最新的國際協調要求����,S5(R3)指出�,在預期對生育力無影響的情況下可采用2種性別同時給藥的試驗���,但是若預期有不良影響�����,則進行單性別單獨給藥的試驗�。而對于男性生殖系統用藥�,因直接作用于男性生殖系統,可能具有較高的生育力風險,因此建議進行單性別單獨給藥的試驗,尤其是雄性單獨給藥后與未給藥雌性進行交配的試驗�,更直接地評價雄性給藥所帶來的生殖毒性風險���。但是�,若綜合靶點及同類藥物信息而預期無生育力風險�����,也可考慮進行2種性別同時給藥的試驗�����。另外�����,因標準的Ⅰ段試驗不能充分發現全部的潛在發育毒性作用��,故若雄性單性別給藥與未給藥雌性交配試驗中出現明顯的胚胎發育毒性信號時,應該考慮開展追加試驗�,如使妊娠動物延長至接近分娩時再行解剖檢查��。對生育力和早期胚胎發育不良影響的可逆性評估�,對風險評估具有重要影響�。對于男性生殖系統用藥,若常規的Ⅰ段試驗發現對雄性生育力和/或生殖系統有不良影響時,應進行追加試驗,進行停藥后可逆性觀察����;若在既往的重復給藥毒性試驗中發現對雄性生殖系統指標有不良影響時�,也應研究其可逆性�。
ICH S5(R3)指出“如果重復給藥毒性試驗中發現對睪丸的損傷,在FEED試驗中,雄性交配前給藥10周覆蓋整個生精周期是合適的,這使得能評估對完整生精周期和附睪運輸的影響”。“當基于藥物的作用機制或以往的試驗資料對生育力有擔憂的理由時�����,可以在重復給藥毒性試驗和/或生育力試驗中納入額外的檢查(例如����,采集精子進行精子計數和形態/活力評估、測量激素水平或監測動情/月經周期),以進一步描述藥物對生育力的潛在影響”��。這是對一般藥物的要求���,對于雄性生殖系統用藥�,由于其具有較高的生殖毒性風險擔憂,建議雄性動物交配前的給藥時間足以覆蓋整個生精周期,并建議在重復給藥毒性試驗和/或生育力試驗中納入額外的檢測指標�����。
另外�,FDA的《藥物研發過程中睪丸毒性評價指導原則》對睪丸毒性的研究提出了較為全面的建議����,FDA的《雄性介導的藥物發育毒性風險評估指導原則(草案)》提供了一些與評估藥物引起的雄性介導發育毒性相關的非臨床研究的內容(見上文“1.2”),關于雄性生殖毒性評價指標有文獻進行了探討�����,可作為男性生殖系統用藥非臨床研究的參考���。
由于男性生殖系統用藥具有通過精液轉移陰道攝入至妊娠伴侶體內從而具有潛在的胚胎-胎仔發育毒性風險��,所以男性生殖系統用藥雖然是單性別用藥�,但開展胚胎-胎仔發育毒性和圍產期發育毒性試驗可有助于識別和評估風險�。
3.2風險識別和控制
風險識別在藥物非臨床評價中起到至關重要的作用,只有識別了相關風險才能進行后續的風險評估和采取必要的風險管控措施����,以保障受試者/患者的安全�����。對于男性生殖系統用藥生殖毒性風險識別主要基于重復給藥毒性試驗和生殖毒性試驗。在新藥早期開發階段��,根據非臨床研究的階段性�����,可能尚未完成生殖毒性試驗���,重復給藥毒性試驗中對生殖器官(包括睪丸和附睪)的組織病理學檢查是初步識別雄性生殖毒性風險的重要內容���。
在臨床試驗風險管控措施方面,正如《ICH M3問與答》建議,“在潛在生殖和發育風險明確之前�,在男性中采取避孕措施是常規做法”����。對于男性生殖系統用藥的生殖毒性風險識別和評估后�����,需要對臨床試驗采取必要的風險管控措施���,以確保受試者或其伴侶胚胎/胎仔安全�。如果雄性介導發育毒性風險未經識別或確定存在�����,應該對受試者或患者應采取的預防措施類型(如使用避孕套和/或可靠的女性用避孕方法)和時限給予建議���,以避免女性伴侶妊娠或孕體暴露�。
男性生殖系統用藥生殖毒性風險評價的最終目的是為藥物及其擬用的適應證整體獲益-風險評估提供依據。對于雄性介導的發育毒性風險�����,需要通過風險管控措施以最大可能避免造成不良妊娠結果����。對于男性生殖毒性的可接受性,需要考慮的因素為該適應證人群的生育需求和雄性生殖毒性的可逆性�����。
對于男性生殖系統用藥生殖毒性風險評價的落腳點為藥物及其擬用適應證的獲益風險比�����,考慮不同適應證對于風險的接受程度不同,需在臨床開發階段進行綜合評價�,降低在后續臨床開發階段的風險����。
4�����、討 論
目前國內已有一些企業開發的男性生殖系統新藥正處于臨床開發階段�。對于此類藥物����,根據具體問題具體分析原則,應根據藥物的藥理/毒理作用機制、同類藥物信息、組織分布(精液分布)����、適應證特點等綜合考慮階段性開展生殖毒性試驗并進行風險評估�����。建議重視重復給藥毒性試驗中對雄性生殖器官的全面組織病理學檢查(必要時納入額外檢測指標),并重視其他試驗中所獲得的雄性生殖系統信息。若在重復給藥毒性試驗和其他試驗中觀察到受試物對雄性生殖系統的不良影響�,或作用機制或同類品種信息提示可能對雄性生育力有影響時�,建議開展單性別給藥的生育力試驗��,且雄性動物給藥覆蓋整個生精周期���;當發現對生育力具有不良影響時���,建議追加試驗�����,如設置合適的恢復期以考察毒性的可逆性����,進行試驗以考察雄性介導的子代發育毒性試驗等。根據受試物非臨床研究結果���,評估其臨床相關暴露可能引起生殖毒性風險,在臨床試驗中應對受試者加強生殖毒性指標監測�����,并采取嚴格避孕措施最大可能避免胚胎-胎仔的藥物暴露�,保護受試者安全。此外�,在藥物上市時����,還需基于非臨床和臨床試驗的所提示的生殖毒性風險信息和相關數據�����,在說明書中進行提示�����,包括所需采取的風險控制措施�,以降低臨床使用中的生殖毒性相關風險���。
本文選自:中國臨床藥理學雜志 第39卷 第20期
作者簡介:周植星����,副研究員����,主要從事新藥藥理毒理技術審評工作
通信作者:黃芳華,主任藥師
作者單位:國家藥品監督管理局 藥品審評中心