您當(dāng)前的位置:檢測資訊 > 行業(yè)研究
嘉峪檢測網(wǎng) 2025-04-13 11:31
2025年4月10日的仿制藥論壇,F(xiàn)DA的Darby Kozak博士發(fā)表了關(guān)于仿制藥批準(zhǔn)的缺陷分析。
基于仿制藥企業(yè)規(guī)模(企業(yè)獲批ANDA數(shù)量)和仿制藥產(chǎn)品復(fù)雜度的近期簡化仿制藥(ANDA)提交分析(2018至2023財年)、批準(zhǔn)率及主要缺陷趨勢:
• 局部皮膚科藥物ANDA的主要生物等效性(BE)缺陷及常見BE缺陷的詳細(xì)分析
• FDA為解決共性問題并促進(jìn)更多首輪和第二輪ANDA獲批推出的行動計劃與專項(xiàng)計劃。

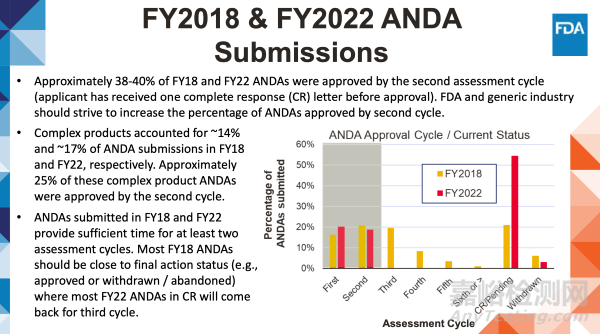
大約38-40%的2018財年和2022財年仿制藥申請(ANDA)是在第二輪審評周期內(nèi)獲得批準(zhǔn)的(申請人此前已收到一封完整回應(yīng)函(CR)后獲批)。美國食品藥品監(jiān)督管理局和仿制藥行業(yè)應(yīng)努力提高第二輪審評周期內(nèi)獲批的ANDA比例。
2018財年和2022財年,復(fù)雜產(chǎn)品分別約占ANDA提交量的14%和17%。這些復(fù)雜產(chǎn)品ANDA中約25%在第二個評估周期內(nèi)獲得批準(zhǔn)。
2018財年和2022財年提交的ANDA材料已獲得至少兩個評估周期的充分審評時間。大部分2018財年提交的ANDA應(yīng)已接近最終處理狀態(tài)(如獲批或撤回/放棄),而2022財年在審評中(CR)的ANDA多數(shù)將進(jìn)入第三輪評估周期。
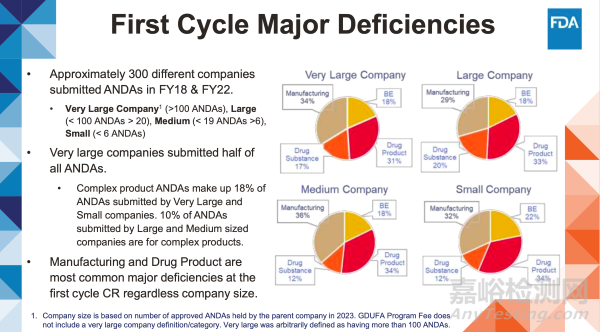
約300家不同企業(yè)在2018財年及2022財年提交了仿制藥申請
• 特大型企業(yè)(遞交100件以上ANDA)、大型企業(yè)(遞交20至100件以下ANDA)、
型企業(yè)(遞交6至19件以下ANDA)、小型企業(yè)(遞交6件以下ANDA)
• 特大型企業(yè)遞交了半數(shù)仿制藥申請。
• 復(fù)雜產(chǎn)品ANDA占特大型和小型企業(yè)遞交總量的18%。大型和中型企業(yè)遞交的ANDA中有10%為復(fù)雜產(chǎn)品。
無論企業(yè)規(guī)模大小,生產(chǎn)與藥品成品缺陷始終是第一輪審評函中最常見的主缺陷項(xiàng)。
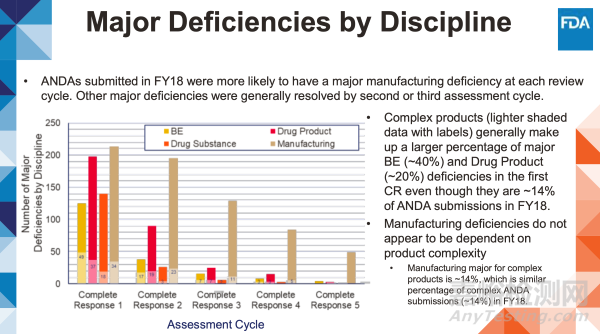
在2018財年提交的仿制藥申請中,每個審評周期出現(xiàn)重大生產(chǎn)缺陷的比例更高。其他主要缺陷通常在第二或第三評估周期得到解決。
• 復(fù)雜產(chǎn)品(顏色較淺并帶有標(biāo)簽的數(shù)據(jù))盡管僅占2018財年ANDA申報量的14%,卻在首次完整回復(fù)函中構(gòu)成了生物等效性缺陷(約40%)和制劑缺陷(約20%)的主要部分。
• 生產(chǎn)缺陷的出現(xiàn)似乎與產(chǎn)品復(fù)雜程度無關(guān)
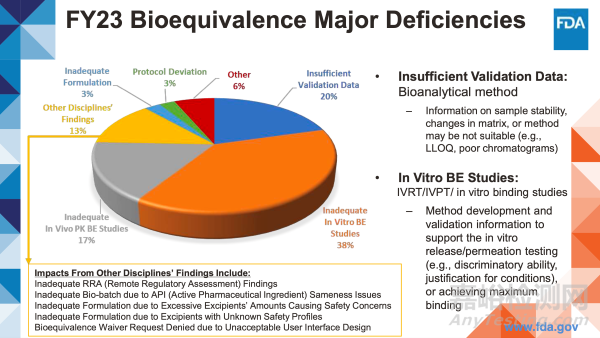
驗(yàn)證數(shù)據(jù)不足:
生物分析方法
– 樣品穩(wěn)定性、基質(zhì)變化或方法的相關(guān)信息可能不適用(如定量下限LLOQ、色譜圖質(zhì)量差)
體外生物等效性(BE)研究:
體外釋放試驗(yàn)(IVRT)/體外滲透試驗(yàn)(IVPT)/體外結(jié)合研究
– 支持體外釋放/滲透測試的方法開發(fā)和驗(yàn)證信息(如區(qū)分能力、實(shí)驗(yàn)條件的合理性),或?qū)崿F(xiàn)最大組合

• GDUFA III倡議和在整個仿制藥流程中加強(qiáng)溝通的機(jī)會,以幫助識別(潛在)重大缺陷的解決方案。
• 溝通交流、開發(fā)會議、學(xué)科審查函(DRL)、信息請求(IR)、中期審評會議、CR后會議等。


結(jié)論:
• 大約40%提交的ANDA在第二個評估周期獲得批準(zhǔn)。其余60%的ANDA仍存在未解決的缺陷,需要更多評估周期且無法獲得批準(zhǔn)。
• 生產(chǎn)(主要與設(shè)施相關(guān))、藥品、生物等效性和原料藥是首次評估周期中發(fā)現(xiàn)主要缺陷最多的方面
• 最常見的主要生物等效性缺陷(38%)源于體外研究不足
體外釋放試驗(yàn)(IVRT)和體外滲透試驗(yàn)(IVPT)研究不足,是采用基于特性生物等效性方法的局部皮膚科藥物ANDA最主要生物等效性缺陷
• FDA和GDUFA III計劃通過加強(qiáng)申請人溝通,提升了ANDA評估效率并減少了常見缺陷
• 產(chǎn)品特定指南、受控函回復(fù)、GDUFA會議、學(xué)科審評信、信息請求、研討會和網(wǎng)絡(luò)會議
• 自2018財年以來收到超過175個局部皮膚科藥物ANDA其中多數(shù)已獲批上市


來源:文亮頻道


