您當(dāng)前的位置:檢測資訊 > 科研開發(fā)
嘉峪檢測網(wǎng) 2020-05-06 09:15
更多醫(yī)藥技術(shù)資訊,請點擊醫(yī)藥專欄:http://drug.anytesting.com/ 歡迎關(guān)注文末微信公眾號:藥研檢測drugtest
強生創(chuàng)新皮下制劑治療多發(fā)性骨髓瘤獲批上市。強生旗下楊森公司新型daratumumab皮下制劑Darzalex Faspro(daratumumab和重組人透明質(zhì)酸酶)獲FDA批準(zhǔn)上市,治療多發(fā)性骨髓瘤患者。Darzalex Faspro可以在大約3到5分鐘內(nèi)給藥,與Darzalex相比,將患者的給藥時間從幾小時縮短到幾分鐘。Daratumumab已多次獲FDA批準(zhǔn)擴展治療多發(fā)性骨髓瘤患者的適用范圍。在一項Ⅲ期臨床COLUMBA中,Darzalex Faspro與靜脈注射Darzalex的總緩解率(ORR)相比達(dá)到非劣效性標(biāo)準(zhǔn),分別為41%和37%。其給藥相關(guān)不良事件也減少近三分之二,分別為13%和34%。
1.石藥門冬氨酸鳥氨酸注射液獲批上市。石藥集團發(fā)布公告稱,其附屬公司石藥銀湖制藥開發(fā)的門冬氨酸鳥氨酸注射液(10ml:5g)獲得國家藥監(jiān)局批準(zhǔn)上市,為國內(nèi)該品種第三家獲批的仿制藥。門冬氨酸鳥氨酸為肝病用藥,適用于因急、慢性肝病(如各型肝炎、肝硬化、脂肪肝、肝炎后綜合癥)引發(fā)的血氨升高及治療肝性腦病,尤其適用于治療肝昏迷早期或肝昏迷期的意識模糊狀態(tài)。
2.恒瑞非布司他片通過一致性評價。恒瑞醫(yī)藥非布司他片獲國家藥監(jiān)局核發(fā)的《藥品補充申請批件》,該產(chǎn)品通過一致性評價。非布司他片是一種非嘌呤類的黃嘌呤氧化酶(XO)選擇性抑制劑,其原研藥由日本帝人開發(fā),商品名菲布力,可用于痛風(fēng)患者高尿酸血癥的長期治療。目前國內(nèi)市場有3家仿制藥企業(yè)及原研廠家擁有該產(chǎn)品生產(chǎn)批文。2018年中國公立醫(yī)療機構(gòu)終端非布司他片銷售額為10.87億元。
3.君實PD-1鼻咽癌適應(yīng)癥上市申請獲受理。君實生物特瑞普利單抗(拓益)新適應(yīng)癥上市申請獲NMPA受理,用于治療既往接受過二線及以上系統(tǒng)治療失敗的復(fù)發(fā)/轉(zhuǎn)移性鼻咽癌患者,這也是全球首個抗PD-1單抗治療復(fù)發(fā)/轉(zhuǎn)移性鼻咽癌的新藥上市申請。在一項Ⅱ期臨床研究POLARIS-02(NCT02915432)中,由獨立評審委員會(IRC)評估的腫瘤客觀緩解率(ORR)達(dá)到了主要終點,且安全性數(shù)據(jù)與特瑞普利單抗過往報道相似。
4.基石藥業(yè)引進(jìn)產(chǎn)品Avapritinib全球Ⅲ期臨床失敗。基石藥業(yè)合作品種胃腸道間質(zhì)瘤(GIST)治療新藥Avapritinib 全球Ⅲ期臨床數(shù)據(jù)公布。該研究旨在評估Avapritinib與瑞戈非尼三線或四線治療GIST的療效和安全性。統(tǒng)計數(shù)據(jù)顯示,Avapritinib組的總體有效率為17%,顯著優(yōu)于瑞戈非尼組(7%);但Avapritinib組患者的無進(jìn)展生存期(PFS)為4.2個月,瑞戈非尼組為5.6個月,PFS中位數(shù)的差異無統(tǒng)計學(xué)意義。Avapritinib 是一款由Blueprint 公司開發(fā)的選擇性KIT/PDGFRA 抑制劑,曾獲FDA授予的突破性療法、快速審評及孤兒藥多重資格認(rèn)定。
5.貝達(dá)藥業(yè)二代Trk抑制劑獲批臨床。貝達(dá)藥業(yè)1類新藥BPI-28592片獲國家藥監(jiān)局批準(zhǔn)臨床。BPI-28592是一種新型強效、高選擇性的原肌球蛋白受體激酶(TRK)二代口服小分子抑制劑,可覆蓋多種癌種,擬用于攜帶NTRK基因變異的局部晚期或轉(zhuǎn)移性實體瘤患者的治療。目前,已有拜耳/Loxo的拉羅替尼和羅氏的恩曲替尼獲批上市,國內(nèi)尚未有TRK抑制劑獲批上市。據(jù)悉,BPI-28592臨床前數(shù)據(jù)顯示安全性很好。
6.和鉑醫(yī)藥合作發(fā)現(xiàn)新冠病毒中和抗體。和鉑醫(yī)藥與荷蘭烏得勒支大學(xué)、伊拉斯姆斯大學(xué)醫(yī)學(xué)中心的科學(xué)家共同宣布,基于和鉑醫(yī)藥的H2L2全人源抗體轉(zhuǎn)基因小鼠平臺,發(fā)現(xiàn)了一款能夠在細(xì)胞培養(yǎng)系統(tǒng)中有效阻斷新冠病毒感染細(xì)胞的全人源抗體47D11。47D11能夠與新冠病毒刺突蛋白受體結(jié)合域的一個保守表位結(jié)合,在細(xì)胞培養(yǎng)試驗中,它雖然不會影響RBD與ACE2受體的結(jié)合,但是能夠有效抑制新冠病毒對VeroE6細(xì)胞系的感染,達(dá)到IC50的濃度為0.57 µg/ml。研究成果發(fā)布在《自然》子刊Nature Communications上。
7.君實與禮來達(dá)成新冠病毒中和抗體合作。君實生物和禮來將聯(lián)合開發(fā)防治COVID-19的抗體療法JS016。JS016是一款由君實生物與中國科學(xué)院微生物研究所共同開發(fā)的重組全人源單克隆中和抗體,能夠特異性結(jié)合新冠病毒表面刺突蛋白的受體結(jié)合域,并有效阻斷病毒與宿主細(xì)胞表面ACE2受體的結(jié)合。根據(jù)協(xié)議,禮來將被授予在大中華地區(qū)外對JS016開展研發(fā)、生產(chǎn)和銷售的獨占許可。雙方計劃在今年第二季度向FDA遞交IND申請并啟動臨床研究。
1.賽諾菲四價腦膜炎球菌結(jié)合疫苗在美獲批。賽諾菲巴斯德四價腦膜炎球菌(A/C/Y/W組)結(jié)合疫苗MenQuadfi獲FDA批準(zhǔn)用于預(yù)防2歲及以上人群的侵襲性腦膜炎球菌引起的相關(guān)疾病。5項臨床匯總結(jié)果顯示,與已上市的四價腦膜炎球菌疫苗相比,MenQuadfi在誘導(dǎo)免疫應(yīng)答方面具有非劣效性。針對4類腦膜炎球菌血清群(A/C/W/Y),在先前未接種過疫苗的受試者中,大多數(shù)(55.4%– 97.2%)受試者在接種后30天內(nèi)發(fā)生由疫苗誘導(dǎo)的免疫應(yīng)答;而在此前接種過疫苗的青少年和成人中,92.2%–98.2%的受試者對每個血清群均有免疫應(yīng)答。
2.瑞德西韋獲FDA緊急使用授權(quán)。FDA宣布授予吉利德瑞德西韋緊急使用授權(quán),治療需要接受氧氣輔助治療的COVID-19住院患者。此次授權(quán)是基于由美國過敏和傳染病研究所(NIAID)贊助的臨床試驗和吉利德公司的開放標(biāo)簽臨床試驗結(jié)果。在NIAID贊助的全球Ⅲ期臨床中,瑞德西韋將患者康復(fù)所需時間降低31%。在吉利德公司的開放標(biāo)簽臨床試驗中,瑞德西韋5天和10天給藥方案療效相似。歐洲藥品管理局日前也已啟動對瑞德西韋的滾動審評。
3.羅氏新冠血清學(xué)檢測試劑獲FDA緊急使用授權(quán)。羅氏Elecsys®Anti-SARS-CoV-2抗體檢測試劑獲FDA授予緊急使用授權(quán)。Elecsys® Anti-SARS-CoV-2是一種體外定性檢測人血清和血漿中新冠病毒抗體(包括IgG)的免疫分析方法,用于確定患者是否已曾受到新冠病毒感染,以及患者是否已產(chǎn)生抗新冠病毒的抗體。據(jù)悉該檢測試劑血清學(xué)試驗的特異性大于99.8%,敏感性為100%(在核酸檢測確認(rèn)患者感染新冠病毒后14天)。醫(yī)院和實驗室可使用的羅氏cobase分析儀進(jìn)行測試,大約18分鐘內(nèi)可提供單個測試的測試結(jié)果。
4.Soligenix光敏療法Ⅲ期試驗結(jié)果積極。Soligenix公司開發(fā)的“first-in-class”光動力療法SGX301,在治療皮膚T細(xì)胞淋巴瘤(CTCL)的關(guān)鍵性Ⅲ期臨床FLASH中,使患者獲得持續(xù)的臨床益處。治療12周后,與安慰劑組相比,SGX301將患者的疾病緩解率提高到40%,與接受治療6周后相比(16%),將患者的緩解率提高了2.5倍。達(dá)到統(tǒng)計學(xué)意義上的顯著改善。SGX301此前已獲FDA授予的孤兒藥資格和快速通道資格。
5.BMS低甲基化藥物CC-486獲FDA優(yōu)先審評資格。FDA已受理百時美施貴寶(BMS)在研口服低甲基化藥物CC-486的新藥申請,用于維持治療急性髓系白血病成人患者,這些患者在接受誘導(dǎo)療法后進(jìn)入完全緩解(CR),或完全緩解伴隨不完全血細(xì)胞計數(shù)恢復(fù)。他們不適合或不選擇接受造血干細(xì)胞移植療法。FDA同時授予其優(yōu)先審評資格,預(yù)計9月3日之前做出回復(fù)。在一項Ⅲ期臨床中,中位隨訪41.2個月時,CC-486治療組患者中位OS為24.7個月,安慰劑組這一數(shù)值為14.8個月(p=0.0009,HR 0.69 [95% CI: 0.55, 0.86)。
6.Vir/Alnylam確定一款治療COVID-19的候選RNAi療法。Vir Biotechnology和Alnylam公司聯(lián)合宣布,已篩選出一款靶向新冠病毒基因組的在研RNAi療法VIR-2703(ALN-COV)。在劑量反應(yīng)測定中,這款候選療法達(dá)到EC50時的濃度小于100 pM,EC95的濃度小于1 nM。而且,VIR-2703預(yù)計能夠?qū)δ壳肮矓?shù)據(jù)庫里超過4300個新冠病毒基因組中超過99.9%的基因組產(chǎn)生活性。它同時能夠?qū)ARS病毒基因組產(chǎn)生活性。兩家公司計劃在年底之前展開這款候選RNAi療法的人體臨床試驗。
1.15000個病毒基因序列均顯示新冠病毒非人造。當(dāng)?shù)貢r間4日,世衛(wèi)組織召開新冠肺炎例行發(fā)布會,針對美國總統(tǒng)特朗普和美國國務(wù)卿蓬佩奧稱新冠肺炎病毒來自武漢病毒研究所,世衛(wèi)組織衛(wèi)生緊急項目技術(shù)主管瑪麗亞·范·科霍夫表示,冠狀病毒一般在蝙蝠中傳播,目前約15000個完整的病毒基因序列都顯示新冠肺炎病毒非人造,世衛(wèi)組織與糧農(nóng)組織和世界動物衛(wèi)生組織以及中國各部門合作,以發(fā)現(xiàn)新冠肺炎病毒的中間宿主動物,來避免再次從動物傳播到人。
2.美國單日新增確診病例逾2萬例。據(jù)美國約翰斯·霍普金斯大學(xué)數(shù)據(jù)實時數(shù)據(jù)顯示,截至北京時間5月5日6時30分左右,全球累計確診新冠肺炎病例3573864例,累計死亡250687例。其中美國累計確診1177784例,死亡68442例。與前一日6時30分?jǐn)?shù)據(jù)相比,美國新增確診病例23163例,新增死亡病例991例。據(jù)《紐約時報》統(tǒng)計,在全美疫情最嚴(yán)重的紐約州,累計確診324357例,累計死亡24788例。
3.跨省異地就醫(yī)人次回升。國家醫(yī)保局對外發(fā)布信息稱,隨著疫情防控取得階段性成果和各地復(fù)工復(fù)產(chǎn),全國跨省異地就醫(yī)3月直接結(jié)算人次比2月有所回升。截至2020年3月底,全國跨省異地就醫(yī)定點醫(yī)療機構(gòu)數(shù)量為28759家,環(huán)比增加437家,其中二級及以下定點醫(yī)療機構(gòu)25898家;國家平臺備案人數(shù)602萬,累計結(jié)算467萬人次。3月跨省異地就醫(yī)直接結(jié)算13萬人次,環(huán)比增加91.2%;醫(yī)療費用30.3億元,環(huán)比增加71.1%;基金支付18.3億元,環(huán)比增加67.2%;日均直接結(jié)算4203人次,次均費用2.3萬元,基金支付比例60.5%。
【澤璟制藥】獲批開展甲苯磺酸多納非尼片與基石藥業(yè)(蘇州)有限公司的抗PD-L1 單克隆抗體CS1001聯(lián)合治療晚期實體瘤受試者的多中心、開放性、劑量探索和劑量擴展的Ⅰ/Ⅱ期臨床研究。
【昭衍新藥】(1)公司2020年一季度實現(xiàn)營業(yè)收入1.55億元(+107.90%),歸母凈利潤1914.70萬元(+59.03%),扣非歸母凈利潤1478.04萬元(+223.57%)。(2)公司《2018年股票期權(quán)和限制性股票激勵計劃》授予的限制性股票第二個解除限售期解除限售條件已經(jīng)成就,本次解除限售股票18.23萬股,上市流通時間為2020 年5月11日。
【興齊眼藥】(1)公司董事、研發(fā)總監(jiān)楊強擬減持股份合計不超過3.75萬股。(2)“貝美前列素滴眼液” 收到藥品注冊受理通知書,用于降低開角型青光眼及高眼壓癥患者的眼壓。
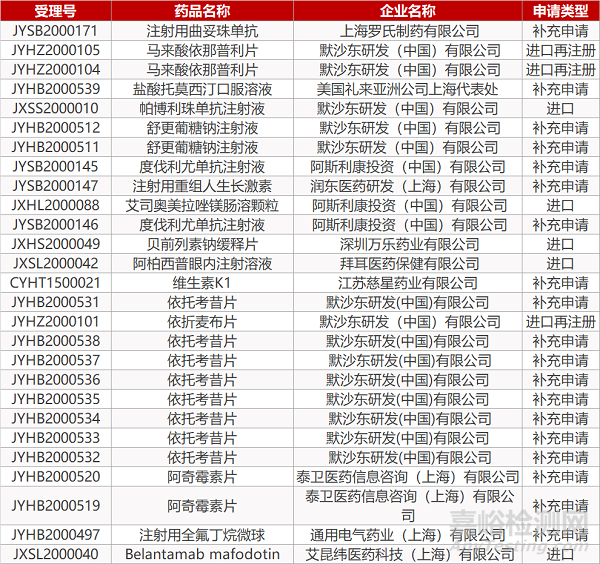
2. FDA最新獲批情況(北美4月30日)

- The End -

來源:藥研發(fā)


