您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2021-06-30 22:48
摘要
納米晶體藥物具有無需載體材料、易工業化和劑型多樣化,且能顯著提高難溶性藥物的溶解度和生物利用度等優勢,已經有多種藥物上市。傳統的納米晶制備技術存在制備效率低和最小可實現粒徑的工藝限制的問題。隨著藥物制劑制備技術的進步,納米晶體藥物的制備技術也在不斷提升,不斷涌現出新的制備技術。新技術的出現大大縮短了工藝時間,使制備更小粒徑的納米晶藥物成為可能。本文從“Top-down”技術、“Bottom-up”技術及組合技術三個方面對納米晶體藥物的制備技術,尤其是高重力控制沉淀法、微射流反應技術和多種組合技術等新型制備技術進行了綜述,并對新型制備技術的發展進行了展望,以期為納米制劑相關研究提供借鑒。
關鍵詞
納米晶體;難溶性藥物;制備技術;溶解度;生物利用度
正文
納米晶體藥物(nanocrystal drugs)是指將原料藥直接納米化,無需載體材料,粒徑小于 1 μm 的藥物顆粒。與原料藥相比,納米晶體藥物的溶解度和溶出度增加,對生物膜的黏附性增大,食物對其干擾降低,其作為藥物遞送系統可進一步固化并加工成各種劑型,涵蓋片劑、膠囊和凍干粉針劑等。目前已經有多種納米晶藥物上市(表 1)。其中,Merck 公司于 2003 年利用納米晶體技術開發了納米制劑阿瑞匹坦膠囊 Emend?,與普通混懸液相比,其不僅提高了人體生物利用度, 而且消除了食物效應,Emend?的服用不受空腹或進食的限制,具有巨大的臨床意義。美國 Par Pharmaceuticals 開發的甲地孕酮口服納米晶混懸液Megace®ES 與普通微米制劑相比,體內吸收速度顯著增加,空腹給藥的生物利用度提高了1.9 倍,而且其給藥體積僅是微米制劑的 1/4,大大增加了患者的順應性。于 2020 年上市的全球首個用于靜脈注射的納米混懸液 Anjeso®,較口服美洛昔康片劑 MOBIC®的達峰時間縮短了 50 多倍,藥峰濃度增加了 4.6 倍,生物利用度提高了約 1 倍,并且其較高的載藥量使其有效止痛時間長達 24 h,該藥有望改變目前臨床上針對急性疼痛的以阿片類藥物為主導的治療模式,具有重大的臨床意義。迄今為止,納米晶體藥物主要有 3 種制備技術—“Top-down”(自上而下)技術、“Bottom-up”(自下而上)技術和組合技術。“Top-down”技術中,原料藥通過一定的機械過程縮小藥物顆粒尺寸至納米范圍,常用方法有濕法介質研磨法(wet media milling,WMM)和高壓均質法(high pressure homogenization, HPH),大部分已上市的納米晶藥物采用這兩種方法制備。“Bottom-up”技術是通過控制藥物的結晶和成核過程得到粒徑在納米范圍的藥物晶體,常用方法是微量沉淀法。組合技術通過將預處理步驟和粒徑減小步驟相結合來制備藥物晶體,多個技術的協同使用在一定程度上能夠改善藥物的粒徑減小效果,并減少能耗。本文從“Top-down”技術、“Bottom-up”技術以及組合技術三個方面系統介紹了納米晶的新型制備技術。
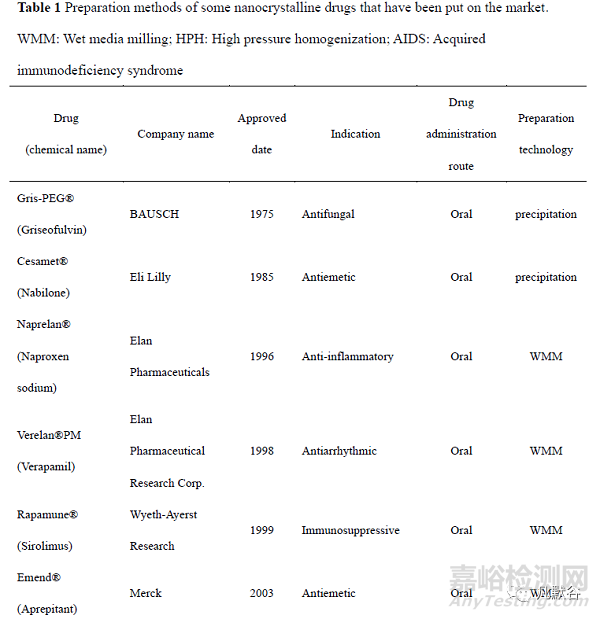

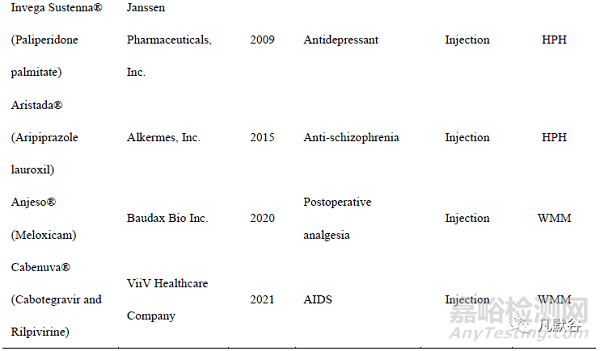
1、“Top-down”技術
1.1 介質研磨法
介質研磨法有干法研磨和濕法研磨兩種。其中濕法研磨工業應用更廣,其原理如圖 1,將懸浮液加入裝有研磨介質的容器中攪拌,在攪拌過程中,藥物顆粒、研磨介質、裝置的器壁三者相互碰撞產生高能剪切力,為藥物顆粒的尺寸減小提供能量輸入[1]。根據生產工藝的差異,此法又有通道式和循環式兩種模式。通道模式中粗混懸液從進料罐進入,研磨形成的納米混懸液輸出到出料罐中,若要獲得粒徑均一的納米晶,需要將出料罐中的混懸液倒入進料罐中或將進料罐和出料罐的位置互換,以進行反復研磨。而循環模式中,混懸液只需要利用一個容器進行循環研磨,這種再循環模式提高了產品的均勻度,使最終晶體的尺寸更小。此法具有操作簡單、成本低,且制得的顆粒粒徑分布較窄的優點[2],在實驗室和工業上得到廣泛應用。但是其最終制得的納米晶藥物中常包裹有殘留的研磨介質,在一定程度上降低了產品的純度。

1.2 高壓均質法
根據使用的儀器和溶液的差異,高壓均質法可分為不溶性藥物輸送微粒技術(insoluble drug delivery particles, IDD-P)、dissocubes技術和nanopure技術[3]。IDD-P技術使用射流均質器對懸浮液進行均質化,其中的藥物通過碰撞而破碎[4]。Dissocubes技術使用活塞間隙均質器進行均質化,混懸液反復以高速通過均質器中狹窄的小間隙,此過程中儀器的壓力逐漸升高,促進間隙中液體沸騰形成氣泡,液體離開間隙時,氣泡遇常壓會破裂產生空化力,促進藥物顆粒破碎[5]。Nanopure技術最突出的特點是可在非水介質中進行,因此適用于易水解藥物的生產。同dissocubes法,藥物在與非水介質混合后,所得的混懸液通過活塞間隙均質器進行均勻化制備。與上述的介質研磨法相比,高壓均質法對環境更友好,沒有研磨介質的污染,工業生產中得到廣泛應用。
1.3 激光燒蝕和破碎技術
近年來激光燒蝕和破碎技術被越來越多地應用于納米粒的制備。在激光燒蝕中,固體被照射后噴射出的物質在周圍的液體中形成納米顆粒。在激光破碎中,微粒的粗懸浮液被輻照后直接破碎成納米顆粒。研究發現,飛秒激光照射比納秒激光照射更能產生納米級的粒子[6]。飛秒激光碎片是由物體內壓增加產生的。飛秒激光產生的多光子被目標表面的分子吸收,超短脈沖時間內目標內的能量快速累積,在轉化為熱量之前,能量在激光焦點周圍產生沖擊波,促進藥物顆粒破碎。而由于脈沖時間較長,納秒激光的能量以熱的形式積聚起來,加熱后的化合物升華成單個分子,在水溶液中重新結晶,形成納米沉淀物。和納秒激光相比,飛秒激光燒蝕的目標不受熱,藥物的降解少。激光燒蝕和破碎的過程中,激光強度、激光的掃描速度、混懸液的性質等因素均對最終納米顆粒的粒徑有影響。激光燒蝕和破碎技術最顯著的優點是操作過程中無有機溶劑的參與,但是此法可能引起小部分藥物的氧化降解和晶型改變。此法已成功用于制備紫杉醇、醋酸甲地孕酮[7]和姜黃素[8]納米混懸液。
2、“Bottom-up”技術
2.1 微量沉淀法
微量沉淀法是將藥物溶液加入到能與溶劑混溶但不能溶解藥物的反溶劑中使藥物沉淀的過程。此法面臨的主要問題是難以對納米晶藥物的尺寸進行精確控制。為了盡量減少納米晶藥物的聚集,操作中常常需要對穩定劑的種類和用量、藥物濃度以及溶劑和反溶劑的比例等參數進行精確篩選和控制。此外,此法制得的納米晶產物中常有有機溶劑殘留。局限于生產過程控制的復雜性和殘留有機溶劑的毒性等問題,目前此法只是在實驗室進行小規模施行,工業化生產中應用得很少。
2.2 高重力控制沉淀法
將“Bottom-up”技術中的沉淀法進行改進能夠獲得更加均勻的小粒徑納米晶藥物。Chen 等[9]于 2000 年提出的高重力控制沉淀法(high gravity controlledprecipitation, HGCP)是一種較有前途的納米晶制備技術,裝置如圖 2,兩股流體沿管道流入旋轉填料床,在轉子的帶動作用下,填料床以每分鐘幾百到幾千次的速度旋轉,兩股流體在高速離心力的作用下進行混合、擴散,并形成小液滴從出口流出。轉速、反應物濃度和體積流量是影響顆粒尺寸的關鍵因素。Chan 等[10]發現,隨著填料床旋轉頻率的增加,納米晶平均粒徑迅速減小,直到在 20~25 Hz 的較高頻率下達到 50 nm 以下的穩定粒徑;超過 25 Hz后,轉速進一步增加不會影響顆粒大小。而反應物濃度與體積流量增加會使溶液的過飽和度和成核速率升高,從而導致小顆粒的生成。HGCP 最大的優點是操作不需要穩定劑。但是在物料的混合過程中,進料流會在湍流邊緣形成局部過飽和,導致連續成核和粒徑分布擴大,此現象會隨著產量的增加而加劇,這一特點使得高重力控制沉淀法的工業化應用受限[11]。此法在實驗室規模中已成功用于制備硫酸沙丁胺醇、多柔比星、索拉菲尼和西羅莫司等納米粒[12-15]。

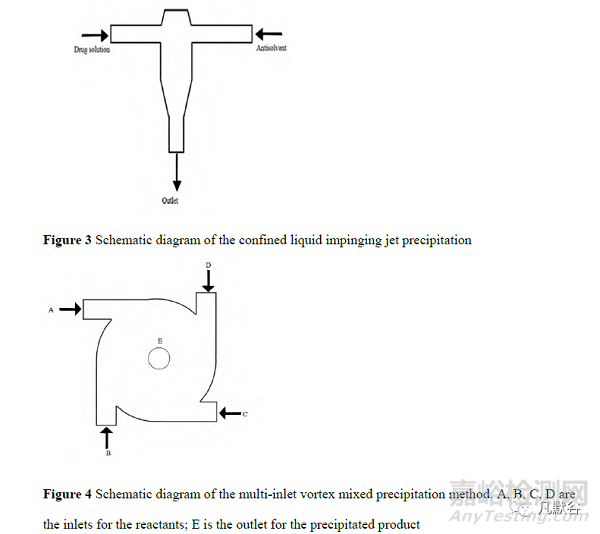
2.3 受限液體撞擊射流沉淀和多入口渦流混合器沉淀法
傳統沉淀法中溶劑和反溶劑混合所需時間較長,而受限液體撞擊射流(confined liquid impinging jet, CLIJ)沉淀和多入口渦流混合器(multi-inlet vortex mixer, MIVM)沉淀能大大縮短沉淀所需的時間。CLIJ 和 MIVM是由微射流反應技術發展而來的兩種方法。CLIJ 過去常常研究其熱傳遞特性,直到 2005 年以后,CLIJ 才被應用于納米化合物的沉淀[16]。如圖 3 為 CLIJ 沉淀法示意圖,藥物溶液直接撞擊反溶劑,當兩股液體射流混合時,反溶劑會使藥物沉淀成細小顆粒。在這個過程中,射流的流體在高速產生的高剪切力作用下擴散并分裂成薄膜,促進液體之間的強烈微觀混合,該過程中的微觀混合時間估計小于 1 ms[17]。注意納米晶顆粒必須要在離開混合區之前形成,否則收集的混合物可能會在靜置期間形成不符合要求的顆粒,進而影響產率。CLIJ 法已成功用于制備粒徑為 53 nm 的氯雷他定、粒徑為 55 nm 的胡蘿卜素、粒徑為 300 nm 的環孢素和硫酸沙丁胺醇等納米顆粒[17-19]。CLIJ 法要求液體射流流量相同,Liu 等[20]于 2008 年提出的 MIVM 則允許不同流量的液體混合。如圖 4 為 MIVM 的原理圖,1個入口連接藥物有機溶液,其他3個入口連接加有穩定劑的水相。藥物溶液和反溶劑在泵內快速充分混合,使短時間內溶液中的飽和度過高,引發快速成核。四流 MIVM 通過改變單個流的流量來控制過飽和度和溶劑組成,進而有效地控制顆粒的生長。此技術能夠對工藝條件進行精確的控制,使懸浮液快速混合。但是此法不適合親水性藥物的制備,工業生產中也難以擴大規模[21]。利用 MIVM 技術已經獲得了粒徑為 20 nm 的姜黃素、粒徑為 100 nm 的熊果酸及粒徑為 317nm 的環孢素等納米藥物[22-25] 。
2.4 冷凍干燥過程中控制結晶
冷凍干燥過程中控制結晶(controlling crystallization duringfreeze-drying, CCDF)是于 2008 年由 de Waard 等[26]發明的一種新興的納米晶制備技術。首先需要制備兩種溶液—低水溶性的藥物在叔丁醇中的溶液和基質(甘露醇)在水中的溶液,然后將兩者混合、冷凍、升溫和干燥。混合后必須立即快速冷凍,以防止藥物過早結晶,從而形成太大的藥物晶體[27]。de Waard 等[28]以非諾貝特為模型藥物利用在線拉曼光譜對此過程進行了跟蹤,發現溶劑結晶發生在冷凍過程中,而溶質結晶發生正在升溫和干燥步驟之間。控制較高的冷凍速率和較低的儲存溫度都有利于較小粒徑納米晶體的形成。目前此法只限于小規模實驗室的應用,其用于大規模生產的可行性還需進一步研究。Zhai 等[29, 30]通過優化CCDF 過程中溶劑組成、藥物濃度和凍干溫度等條件,制備出了生物利用度有明顯提升的黃體酮納米晶,說明 CCDF 有一定的應用前景。
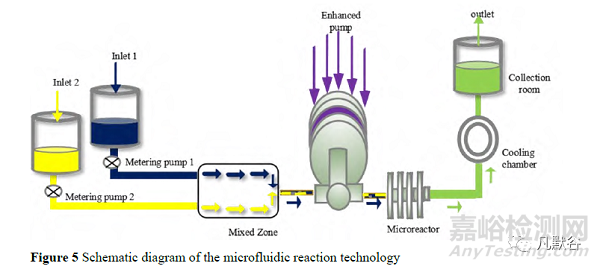
2.5 微射流反應技術
微射流反應技術(microfluidic reaction technology, MRT)是 2010 年由 Microfluidics 公司發明的一種利用噴射流原理縮小晶體尺寸的方法,是近年研究的熱點。裝置主要由計量泵、強化泵、微反應器和冷卻裝置構成。如圖 5,反溶劑和藥物溶液經進料口加入,兩者的比例經計量泵控制,在混合區兩者進行初步混合,形成的混懸液以預定的速度流入強化泵,強化泵對流入的混懸液加壓,達到指定壓力后,混懸液通過噴嘴以超高速迸射進入微反應器。在微反應器內,噴射流相互碰撞,在強烈的空穴效應和剪切效應下顆粒粒徑減小[31]。為了降低由于黏性能量耗散而在加工過程中升高的流體溫度,產物在最終進入收集室前會先進入冷卻裝置[32]。反應物在進入微反應器之前會有一些混合,但是由于流體的接觸持續時間很短(<1 s),且流動為層流,混合保持在最低限度。反應器內液體的混合強度比反應器前的混合強度高一個數量級。微流體反應技術最大的優點是能夠連續化和規模化生產納米晶體,并且制得的產品粒徑較均一,但是此法仍然存在能量消耗大和通路易堵塞的缺點。Aghajani 等[33]利用人工神經網絡建模,確定在溶劑溫度較高、流速較低,而反溶劑流速較高時,所得的納米晶懸浮液的多分散性指數(polydispersity index, PDI)較低。達那唑[34]、氫化可的松[35]、頭孢呋辛酯[36]和阿托伐他汀[37]等納米晶均可采用微射流反應技術制備。
2.6 利用酸堿反應產生的 CO2 輔助沉淀法
利用酸堿反應產生的 CO2 輔助沉淀是于 2016年由 Han 等[38]提出的一種利用化學反應產生的外部能量來減小藥物粒徑的方法。此法不需要任何特殊的能量輸入設備,操作簡單易行。首先利用有機溶劑與有機酸和穩定劑一起溶解難溶于水的藥物,然后將溶液旋轉蒸發干燥得到酸相,最后加入碳酸鹽水溶液,溶液發生酸堿反應快速生成 CO2 氣泡,所生成的 CO2 氣泡起快速微觀混合作用,而穩定劑同時吸附在藥物的疏水表面,能夠抑制納米晶的聚集,實現藥物的納米懸浮。Wang 等[39]將姜黃素、穩定劑和酸溶解在有機溶劑中,旋轉蒸發干燥得到酸相。在酸相中加入碳酸鹽溶液,得到粒徑約 100 nm 的姜黃素納米懸浮液。Wang 等[40]利用此法制備了粒徑為 302.8 ± 2.0 nm 的他克莫司納米懸浮液。Kathpalia 等[41]發現,與利用反溶劑沉淀法制備的產品相比,用此法制備的atovaquone 納米懸浮液的藥物粒徑更小,溶解度更大。
3、組合技術
3.1 Nanoedge 技術和 H69 技術
Nanoedge 技術是沉淀法和高壓均質法等高能技術的組合技術,是 Baxter 于 2003 年提出的首個用于生產納米晶的組合技術。操作時先將藥物溶解在有機溶劑中,再與水性溶劑混合,藥物因為在水性溶劑中溶解度低而形成半晶型或無定型沉淀,之后將形成的沉淀利用高壓均質法等高能技術增強其結晶度,形成更加穩定的結構[42]。該技術在一定程度上能夠解決沉淀法制得的納米晶的穩定性問題,并改善高能技術的粒度減小效果。此法已成功用于制備粒徑約為 300 nm 的奈韋拉平[43]、粒徑為 100~200 nm 的兩性霉素 B[44]、粒徑為 200 ±4 nm 的聯苯雙酯[45]和粒徑為 173.21 ±0.9 nm 的槲皮素[46]等納米混懸液。
在理想情況下,Nanoedge 方法中沉淀和高壓均質步驟之間的時間應盡可能短,以獲得更小粒徑的納米晶,最好直接在均質機的擴散區內進行沉淀。Mueller 及其同事于 2006 年發明的 H69 技術可以做到在微量沉淀形成納米晶的同時有高壓均質的空化力作用于藥物顆粒[47]。操作時先將藥物溶解在溶劑中,然后與水性非溶劑混合,兩種液體接觸時會產生沉淀,顆粒形成發生在均質機的高能區,空化和剪切力立即作用于新形成的藥物顆粒,使粒徑減小[9]。Li 等[48]利用 H69 技術制得了熊去氧膽酸納米晶體,他們發現,與單用高壓均質法相比,組合技術可以顯著提高粒徑減小效率。Sinha 等[49]利用 H69 技術制備了粒徑為 304 nm 的布洛芬納米晶體。H69 工藝能夠制得單靠高壓均質無法生產的 100 nm 以下的納米晶藥物。Moeschwitzer 等[47]利用 H69 技術制備了粒徑為 22 nm 的超小型納米晶。
3.2 H42 技術
2005 年 Pharmasol 公司將噴霧干燥法和高壓均質法兩種技術相結合用于納米晶藥物的制備,即為 H42 組合技術。Sosnik 等[50]發現,噴霧干燥后的藥物粉末通常具有不同的物理性質—粒度更小、結構更多孔,這在一定程度上降低了后續處理過程中均質器堵塞的風險。此外,噴霧干燥技術得到的粉末具有更好的流動性,且過程不涉及高能耗的冷卻工藝,所以此法成本較低,適合大批量生產藥物。但是傳統的噴霧干燥技術容易導致產品在干燥室壁中的損失,不適合小規模實驗室的應用。Liu 等[51]將白藜蘆醇分別使用標準高壓均質法和 H42 組合方法進行處理,發現組合技術制得的納米晶粒徑較高壓均質法減小了 2 倍。Gao 等[52]發現,噴霧干燥后的醋酸氫化可的松在 1 500 bar 下進行一次均勻化循環所得的藥物粒徑小于使用研磨法進行 20 次循環后所得藥物的粒徑,H42 技術可使顆粒尺寸減小所需的能耗降低。
3.3 H96 技術
Moschwitzer[53]于 2006 年申請了由 H96 工藝制備的兩性霉素 B 納米混懸液的專利,制得產品的最終粒徑為 62 nm。H96 技術是將冷凍干燥法與高壓均質法相結合的技術[5]。冷凍干燥過程包括 3 個步驟:冷凍、一次干燥(冰升華)和二次干燥(從固相中除去水)。經過冷凍干燥處理后藥物的某些物理性質會發生變化,如質地會更加疏松多孔,潤濕性也會增加,在穩定劑溶液中藥物分散會更加均勻。Ma 等[54]利用掃描電子顯微鏡(scanning electronmocroscope,SEM)觀察到冷凍干燥后的藥品表面為更加光滑的棒狀形態。藥物的這些物理性質的改變為高能技術在較短的時間內生產小粒徑藥物創造了條件[55]。Hu 等[30]利用 H69 技術制備了粒徑為 162 nm 的核黃素納米懸浮液。Salazar 等[55]以格列本脲為模型藥物,證明了經過冷凍干燥預處理藥物的粒徑減小效率比未經處理的藥物顯著提高,H96 技術能夠成功應用于生產小粒徑的納米晶體藥物。
3.4 超聲法聯合反溶劑沉淀法
超聲法以其操作簡單、成本低,且超聲波的能量高、穿透性好的優點而備受青睞,但是其制得的納米晶藥物的均勻性較低,將其與反溶劑沉淀法相結合可增加納米晶藥物的均勻性。超聲法和反溶劑沉淀法聯用時,由于超聲波的空化作用,溶液會在負壓階段形成空泡。在隨后的壓縮階段,形成的真空泡群會在壓力的作用下破裂,釋放出大量的能量和強大的沖擊波,進而使溶劑和反溶劑的混合增強,同時強大的沖擊波也會導致顆粒破碎,使顆粒的粒徑減小[56]。Ige 等[57]通過實驗發現,超聲時間為 10 min 是可以減小顆粒尺寸并防止晶體生長和團聚的最佳時間。Zhang 等[58]在沒有使用表面活性劑的情況下,利用超聲和反溶劑沉淀法成功制備了至少 6 個月穩定的喜樹堿納米晶。Sharma 等[59]發現超聲能夠使沉淀法制備的替米沙坦納米混懸液的粒徑進一步降低 35%,超聲和反溶劑沉淀法聯用還可制得粒徑為 209 ± 9 nm 的尼群地平[60]、粒徑為 339 nm 的美洛昔康[61]和粒徑約為 175 nm 的雙硫侖[62]等納米混懸液。
基于以上所述,表 2 列出了一些納米晶的新型制備方法的優缺點。



4、結語和展望
目前已經有大量文獻報道了納米晶藥物在生物利用度的改善方面的積極成果,納米晶體作為難溶性藥物遞送系統具有巨大的潛力。為了進一步促進納米晶藥物的發展,相關的藥物研發企業需集中精力優化可擴展的工藝和配方,并積極開發納米晶藥物的新型制備技術。新型制備技術的多樣化為不同特性納米晶藥物的制備提供了契機。但是現有的大部分納米晶新型制備技術本身發展仍然不成熟,還存在各種各樣的問題,如用于生產的設備過于昂貴、生產過程中耗能過高等。此外,受限于技術本身擴大化發展的難度,目前大部分納米晶新型制備技術仍然處于實驗室的小規模實踐階段,其工業化擴大還面臨很多阻礙,需要更深的探索。
未來在對納米晶新型制備技術的探索過程中可適當應用“質量源于設計”(Quality byDesign, QbD)來優化納米晶的制備工藝和處方,也可以結合人工智能網絡中的深度學習,利用大數據網絡對運用某技術成功制備納米晶的處方進行篩選和歸類,再結合藥物本身的特點(如藥物的疏水性和熱敏感性等)選定針對藥物的最佳制備技術。相信在不遠的將來,納米晶的制備技術會趨于完善,納米晶會應用到更廣泛的制劑領域。
作者 | 田陽,彭一凡,張志偉,張慧,高翔
軍事科學院軍事醫學研究院毒物藥物研究所

來源:藥學學報


