在當前能源需求和氣候變化的背景下,可持續能源系統的研究已取得實質性進展。可再生能源的大規模應用需要高效的電能轉換和高密度的電能存儲技術,以實現能源分配。氫-水電化學轉化被視為一種理想的、無化石原料使用的可持續能源系統,目前該能源系統中電解水和燃料電池兩種核心技術的能量轉換仍有較大改進空間,亟需進一步實現技術突破。
中國工程院院刊《Engineering》2020年6月刊發重慶大學魏子棟教授研究團隊的《電化學氫-水轉化系統中電解水和氫燃料電池催化劑的設計》一文。文章分析氫-水能源系統中電解水和燃料電池的能量耗散,討論在催化劑表面發生的涉及氫-氧反應的主要障礙,總結出催化活性趨勢的框架,概述電化學氫-水轉化系統中的關鍵科學問題,提出開發具有高能量轉化率的催化劑的研究方向,為高活性氫-氧反應電催化劑的設計提供思路。
一、引言
目前全球能源消耗持續增長,但近88%的能源經濟依賴化石燃料。盡管化石燃料在能源組合中所占份額過大,但化石燃料時代或許即將結束。化石燃料大量消耗或無利可圖的開采只是時間問題。除了供應量減少的問題外,化石燃料的使用對全球生態系統構成了重大風險。目前,世界上的能源供給主要依靠化石燃料的燃燒。這種燃燒所產生的副產品嚴重污染空氣、土壤和水。我們迫切需要采用新的思維方式,以便找到解決這些問題的方案,并設計更安全、可持續的能源供應系統。可再生能源將在世界能源未來中發揮至關重要的作用。然而,可再生能源和傳統能源之間的巨大差異造成了市場壁壘。可再生能源產生的能量可能在短時間內發生不可預測的變化。例如,太陽能系統僅在陽光照射時產生能量。其他可再生能源,如風能和潮汐能,同樣具有不穩定性這一不利因素。這種不穩定性使當前的可再生能源發電的可靠性低于化石燃料產生的能源,因為其輸出高度依賴于天氣條件和時間。為了使可再生能源大規模應用,需要高效的電能轉換和高密度的電能存儲技術,以實現能源分配。
電化學氫-水轉化(H2+O2 ? H2O)是一種清潔高效的可持續能源系統執行解決方案。具體來說,可再生能源可以通過水電解轉化為儲存在氫氣中的化學能。相反,氫分子可以通過電化學的方式重組成水,以便通過燃料電池輸出電能。在該能量系統中,氫充當能量載體,并且能量轉換與熱循環無關。因為該系統是基于電化學反應,可以有效地避免對自然環境和人類健康有害的氣體和化合物的釋放。
然而,在實際應用中,氫氣必須首先被獲取,然后被儲存,最后被轉換回水以釋放儲存的能量。為了實現這一目標,高效、低成本的水電解和燃料電池技術必須有效地結合起來。電化學過程是這些能量轉換技術的核心,包括水電解技術中的析氫反應(HER)和析氧反應(OER),氫氧燃料電池中的氧還原反應(ORR)和氫氧化反應(HOR)。這四種電化學反應的效率對上述能量轉換技術的輸出性能有很大的影響。因此,在該可持續能源系統中,最關鍵的問題是如何在催化電極表面有效地催化以上反應,以獲得最低的過電位和最高的電流密度。除了電化學反應引起的電壓降外,內阻和傳質電阻等也會影響水電解和燃料電池的總電壓。因此,通過優化電極結構來加速電子、質子的轉移和產物的脫附是另一個需要關注的問題。
文章對用于電化學氫-水轉化電催化劑的結構工程的最新進展進行了全面綜述。主要討論了兩個問題:① 電化學氫-水轉換系統能量耗散的來源;② 基礎科學與實用技術相結合驅動的高能量轉換效率電催化劑的結構設計。在簡要介紹了氫-水轉化過程中的電化學過程之后,我們從實用的角度回顧了水電解和燃料電池兩種功能技術的能量耗散,并利用經典動力學分析了催化劑表面發生電化學反應的關鍵障礙。借助于反應中間體之間的標度關系,我們構建了一個了解催化性能趨勢的框架,為開發用于廣泛反應的高效催化劑提供指導。總結了設計高性能電催化劑的通用策略,并討論了它們的優缺點。這部分介紹了通過結構設計實現的高效電催化劑的典型案例,展示了合成化學、電催化化學和計算化學的有機結合。最后概述了電化學氫水轉化系統中的關鍵科學問題,為高效、可再生能源系統的催化劑設計提供了方向。
二、電催化基礎
(一) 氫-水轉化中的電化學反應
如圖1所示,該可再生清潔能源系統涉及兩種不同的功能技術:電解水和燃料電池。這兩種技術的電解槽主要由四部分組成:電解液(如H2O)、離子交換膜(如Nafion膜)、陽極電極和陰極電極。為了提升這兩種技術的效率,陰陽電極表面一般涂覆著高效穩定的催化劑層。在水電解槽中,電能被消耗以將水分解為氣態氫(H2)和氧(O2)。以酸性水電解為例,當電子通過外回路時,質子通過離子交換膜進入陰極,與電子結合形成氫分子,水在陽極氧化形成氧分子和質子。
圖1 氫-水的電化學轉換中電解水和燃料電池的反應原理圖
燃料電池中發生的電化學反應與水電解過程完全相反。氫和氧的自然“冷”燃燒發生在燃料電池裝置中,其中氫作為燃料,氧作為氧化劑。通常,氫通過電極孔擴散到陽極表面。通過催化劑層的催化作用,吸附的氫被電離并在電極上釋放出一個電子。接下來,通過電解液的氫離子和通過外部電路的電子都到達陰極,與氧分子重新結合形成水分子,并釋放出電流。通過使用合適的水或空氣冷卻系統,可以消除內部反應和電阻產生的熱量。表1總結了水電解和燃料電池在不同介質中的半電池反應。這四個反應可分為兩個可逆反應對:相對于可逆氫電極(RHE),平衡電位(U0)為0 V的HER和HOR,以及U0 =1.23 V的ORR和OER。從化學角度來看,氫-水轉化是由兩個氧化還原對組成的:高電位的水/氧對和相對低電位的水/氫對。在酸性介質中,水合質子將電荷從陽極轉移到陰極,而在堿性電解質中,氫氧化物離子作為電荷載體從陰極轉移到陽極。
表1 在酸性和堿性電解質中電解水和燃料電池的半電池反應
(二)水電解和燃料電池的能量耗散
根據氫-水轉化的反應熱力學,水電解和氫氧燃料電池在標準條件下具有相同的起始電位(1.23 V)。然而,這兩種技術的實際起始電位與標準電位相差甚遠。在實際操作條件下,即使使用最先進的貴金屬作為電催化劑,燃料電池的電壓始終低于0.9 V,而水電解高于1.8 V。在實際應用中,為了驅動電化學反應過程,必須克服許多勢壘,包括電路的電阻、電化學反應的活化能、產物氣泡或水對電極表面的堵塞,以及電解質溶液的離子轉移電阻等。這些勢壘需要足夠的電能供應以克服,這大大降低了能量轉換效率,導致工作電位低于熱力學電位,即發生所謂的極化現象。
圖2示出了典型的液體電解質電池中的電阻(即勢壘)。兩端的第一個電阻是外部電路電阻,包括陽極和陰極的導線和連接的電阻以及電子穿過催化劑層的電阻。在水電解中,由于產生的氣泡對電極表面的覆蓋,阻礙了電極與電解液的接觸。類似地,產物水在電極與反應物氧氣之間起到阻塞作用,導致堿性燃料電池(AFC)中的傳質阻力。
圖2 (a)典型的液態堿性燃料電池示意圖;(b)電解池的橫截面;(c)等效電路
以上電池系統中的電阻可分為三類:活化電阻(電化學反應引起的損耗)、歐姆電阻(離子和電子傳導引起的損耗)和濃度電阻(物質傳輸引起的損耗)。這三類電阻共同決定了電化學電池的電流-電壓(i-V)曲線的特征形狀。圖3顯示了水電解和燃料電池的典型i-V曲線。在水電解的i-V曲線中[圖3(a)],當電壓高于熱力學電解電壓1.23 V后,電流開始流過電解池。在低電流密度下,歐姆電阻引起的電壓降很小,反應活化過電壓占電壓降的主要部分。此時極化曲線的對數形狀(Tafel區域)歸因于陽極和陰極的電荷轉移現象。隨著過電壓的進一步增大,反應活化勢壘減小,極化曲線呈線性。這種線性形狀表明此時歐姆電阻是電解池的最關鍵動力學參數。在燃料電池的i-V曲線中[圖3(b)],活化電阻主要影響曲線的初始部分,歐姆電阻的影響主要在曲線的中間部分,濃度電阻的影響在曲線的尾部顯著。盡管這兩種功能技術中發生的反應是可逆的,但i-V曲線的形狀并不相同:水電解的i-V曲線在高電位下通常遵循Butler-Volmer模型;而由于對傳質速率的限制,燃料電池的i-V曲線往往在高電位下顯示恒定值。
圖3 水電解(a)和燃料電池(b)的極化曲線圖
為了提高兩種技術的能量轉換效率以改善能源系統的整體性能,必須了解上述電阻產生的緣由,以便將其最小化。歐姆損耗是由電極材料對電子流的電阻和電解液對離子流的電阻引起的。這些損耗可以通過使用高導電材料作為布線和電極基板,以及通過減小兩個電極之間的距離來降低。通過增加氣態反應物的壓力或液體電解質的濃度,可以減輕由傳質引起的損耗。這兩種電壓降主要取決于電池的設計和運行條件。除了上述兩類電阻外,電化學電池中的大部分電壓降(>60%)是由半電池反應的吉布斯自由能變化引起的。根據反應的方向,活化極化大大增加發生氧化反應的陽極電壓,并降低了發生還原反應的陰極電壓。
在電化學中,Butler-Volmer關系被用作主要出發點,將催化劑-電解質界面上的過電壓(η)與該界面上的電流密度j(A·cm–2)聯系起來:
式中,η是過電壓,即界面上的實際電壓與平衡電壓之差;j0是交流電流密度,單位為A·cm–2;α是電荷轉移的系數;n是在電化學反應中轉移的電子數;F≈96485 C·mol–1,是法拉第常量;R是摩爾氣體常量(0.082 J·K–1·mol–1);T是熱力學溫度(K)。Butler-Volmer方程表明,電化學反應產生的電流隨過電壓和交換電流密度呈指數增加。實際上,j0表示反應物與產物處于平衡狀態時的“交換速率”,是提高反應速率的重點。為簡單起見并考慮濃度效應,正向反應下j0的定義為:
式中,c是反應物的表面濃度;f是產物的衰減率;ΔGact是正向反應的活化勢壘。等式(2)清楚地表明,在給定的環境條件下,減小活化能壘(ΔGact)將增加j0。在實際反應中,只有處于活化狀態的物質才能經歷從反應物到產物的轉變。催化電極是物質活化和轉變的場所,反應的活化能極大程度上取決于電極材料。因此使用高性能的催化電極可顯著降低反應的活化勢壘,進而顯著提高j0。基于對活化能、電極材料和表面構型之間關系的理解,現今大量的研究工作集中于高效催化電極材料的設計以降低電極反應的活化能。
(三)用于電化學氫-水轉化的催化劑設計指南
根據反應機制,反應活化勢壘(ΔGact)可以用平衡電勢下速率決定步驟(RDS)的自由能變化(ΔGmax)來定量,并且其在不同催化材料上的理論值可以通過密度泛函理論(DFT)來計算。通過繪制j0與ΔGmax之間的火山曲線,可以建立活化能與電極材料之間的關系。最常見的火山曲線是基于Langmuir吸附類型的析氫反應速率描述,其最大值位于氫吸附自由能(ΔGH*)為零附近。在析氫反應中,反應物首先吸附在催化劑表面形成反應中間體(M-Hads)。在上述Volmer步驟之后,氫分子可以由電解液中電子和質子通過Heyrovsky步驟耦合形成,或者通過Tafel步驟直接結合形成。因此,氫吸附自由能(ΔGH*)是析氫反應速率的決定性因素。
近年來,DFT計算得到的材料表面的氫吸附自由能被廣泛用作許多傳統金屬和非金屬催化材料的活性描述符。如圖4(a)所示,不同金屬的析氫交換電流密度存在顯著差異,位于火山曲線頂部附近的金屬(如Pt)具有最佳的ΔGH*。如果催化材料對氫的吸附力較弱,氫原子在材料表面幾乎不能被吸附,整個反應速率由氫的吸附步驟(Volmer步驟)決定。反之,氫原子在催化材料上的吸附太強,M–Hads鍵則很難被打斷而形成H2,反應決速步為解吸步驟(Heyrovsky/Tafel)。作為HER的逆過程,HOR的RDS是H2在催化劑表面的解離吸附,它涉及電子從催化劑表面轉移到H2分子的反鍵軌道(σ*軌道)因此,M-Hads的強弱在HOR的動力學中也起主導作用,并且由于這兩個反應的高度可逆性,HOR在貴金屬表面上的活性趨勢與HER相同[圖4(b)]。
圖4 (a)各種材料表面HER交換電流密度(j0)和ΔGH*的關系圖;(b)酸性介質中表面歸一化的HOR/HER交換電流密度(j0)對ΔGH*的火山曲線圖;(c)不同金屬的ORR活性和ΔGO*的關系圖;(d)氧化物的OER活性對ΔGO*–ΔGOH*圖
與氫參與反應相似,j0和ΔGmax之間的關系也應用于氫-水轉化過程中氧參與的反應。如圖4(c)、(d)所示,除了決定反應速率的反應中間體不同,氧參與反應的火山曲線形狀非常相似。ORR包括以四電子途徑將氧還原為水,或以兩電子途徑生產過氧化氫。事實上,一個直接的四電子ORR反應機制可以是一個解離或結合過程,這取決于催化劑表面的氧解離能壘。因此,ORR火山曲線以氧吸附自由能(ΔGO*)與催化活性相關聯[圖4(c)]。對于與氧結合太強的金屬,ORR反應速率受到O*或OH*物種脫附的限制。對于與氧結合太弱的金屬,反應速度可能受O2中O–O鍵分裂的限制(解離機制),或者受電子和質子轉移到吸附的O2的限制(結合機制),具體情況取決于外加電位。如圖4(c)所示,即使鉑(Pt)也不在絕對峰值,ΔGO*略低于鉑的金屬應具有更高的氧還原活性。根據上述熱力學火山曲線,Nørskov等考慮到氫氧結合能是變化的,建立了ORR的微觀動力學模型。他們發現了一種與熱力學活性火山曲線非常一致的動力學火山曲線,并確定了ΔGO*比Pt(111)弱0.1 eV的催化劑具有最佳的四電子ORR活性。
OER火山曲線始于1984年,具有很長的歷史。當時Trasatti用金屬氧化物中金屬從低氧化態到較高氧化態的轉變焓來描述氧化物電極的OER電催化活性。這項開創性的工作將OER過程視為表面配位化合物的兩種不同構型之間的過渡。因此,所有難氧化或易氧化的金屬氧化物對OER催化都不是很活潑。難氧化意味著中間體的吸附性較弱,水離解是RDS。反之,易氧化性表明中間產物具有很強的吸附性,則O*或OH*的脫附為RDS。因此,與ORR相同,OER反應速率與ΔGO*有關。
然而,四電子OER涉及多個中間體(OOH*、OH*和O*),它們的結合能緊密相關且幾乎不解耦,用ΔGO*作為OER活性的單一描述符并不準確。不同的反應中間體的結合能之間存在線性標度關系,即如果與一個反應步驟相關的能量發生變化,其他反應步驟的能量也發生變化。Man等將兩個中間產物(ΔGO* – ΔGOH*)的結合能之差作為化合物(包括金紅石、鈣鈦礦、尖晶石、巖鹽和方鐵錳礦氧化物)催化活性的描述符[圖4(d)],其活性很好地服從火山曲線。在金屬氧化物材料中,各吸附位點的OH*和OOH*結合能(無論是在OER還是ORR中)均以大約3.2 eV的恒定能量值相互關聯。由于OOH*和OH*之間的非理想標度,即使對于OER和ORR火山曲線頂部的催化材料,催化劑也存在最小理論超電勢(0.3~0.4 V),包括最優的RuO2析氧催化劑和Pt基ORR催化劑。
火山曲線恰當地證明了Sabatier理論,即理想的催化劑與反應中間體結合既不太弱也不太強。換言之,對反應中間體具有適當結合能的催化劑表面可實現最佳催化活性。具體來說,最理想HER/HOR催化劑是具有最小ΔGH*絕對值的材料,理想ORR和OER催化劑則具有優異的ΔGO*和ΔGO* – ΔGOH*。除了降低活化勢壘外,還有另一個顯著的方法來增加j0,即增加單位面積內反應位點的數量。j0表示單位面積的反應電流,而電流密度的面積通常基于電極的幾何面積。表面極其粗糙的電極的真實電極表面積可以比其幾何電極面積大幾個數量級,因此可以提供更多的反應位點。因此,粗糙電極表面的有效j0將遠大于光滑電極表面的有效j0。提高活性位點密度的另一個簡單方法是增大給定電極上催化劑的用量。然而,過量的催化劑會阻礙電極表面的電荷和質子轉移。因此,電極的活性不隨催化劑用量的增加而線性增加。
總之,提高電催化劑體系的活性(或反應速率)一般有兩種策略:① 提高每個活性位點的本征活性;② 提高給定電極上活性位點的數量。兩種方法各有利弊。不同催化劑的本征活性差異可能超過10個數量級,而由催化劑負載引起的活性差異僅為1~3個數量級。提高每個活性位點的本征活性是實現高活性的最根本、最有效的途徑,但其實現必須建立在對反應機制和材料性能深入了解的基礎上。增加活性位點的數量是一個更簡單的策略,但活性增長是有限的。同時,通過提高催化劑負載量來提高活性需要以增加電極成本和傳質阻力為代價。在實際應用中,以上兩種策略可以同時實施,從而大大提高催化劑的活性。
三、電化學氫–水轉化中催化材料設計
(一)納米構筑
眾所周知,催化劑的電流密度隨著活性中心密度的增加而增加。暴露更多的活性中心對獲得高催化活性十分重要。納米構筑被認為是提高活性位點密度最直接有效的策略。在過渡金屬合金體系中,人們首先認識到實際活性表面積與電催化劑整體性能之間的關系。
早在1982年,Brown等發現合金表面通常比單一金屬表面粗糙,可以為催化反應提供更多的活性中心。借助于Ni-Mo合金納米結構化和鉬的選擇性腐蝕,Ni-Mo合金的表面積大大增加,催化活性明顯提高。
近十年來,隨著合成技術的快速發展,一系列不同形貌的電催化納米材料相繼問世,包括納米籠、納米纖維、納米花、納米泡沫、納米網、納米針、納米環、納米殼、納米線等。Faber等報道了金屬二硫化鈷(CoS2)作為一種高活性催化劑,并證明了幾何結構在決定其整體催化性能中的關鍵作用。與常見的納米顆粒和納米薄膜形貌的電極相比,微納米結構電極的高活性比表面積顯著改善了其催化性能(圖5)。因此CoS2納米線電極只需低至145 mV的過電位以驅動–10 mA·cm–2的析氫電流密度。此外,通過促進物質傳遞和產物(氣泡或水)從催化劑表面的脫除,納米結構具有提高操作穩定性和反應速率的雙重功能。Peng等使用自組裝和預成形策略,可控合成了具有二維(2D)層狀結構的Mo2C/C催化材料。高分散的Mo2C納米顆粒及二維層狀結構有效地促進了Mo2C活性中心的質子和電荷轉移,促進了電化學HER過程。此外,我們還進一步合成了一系列三維納米催化材料,包括NiCo2(SOH)x納米花、珊瑚狀FeNi(OH)x、Ni-VC納米叢、Ni-Mo2C納米線和Ni(OH)2@Ni2P納米柱。所有這些材料都具有高活性表面、快速電子轉移和氣體逸出通道,有利于催化水電解反應進行。
圖5 (a)~(c)不同形貌CoS2的掃描電鏡圖(SEM);CoS2電極電化學表征(d)和穩定性測試(e);(f)不同結構的CoS2氫氣逸出示意圖
在燃料電池催化劑設計中,納米結構的優化同樣十分重要。在長時間的操作過程中,ORR催化劑中除了自身活性衰減外,還可能會因水淹而導致燃料電池快速失活。由于多孔通道被積水阻塞,水淹將中斷活性位點的氧氣供應,導致淹沒區域的ORR終止。為了量化燃料電池中電催化劑的孔特性對其傳質和抗水淹性能的影響,Wang等為ORR催化劑設計了一種特殊的“撥浪鼓”狀工作電極。雙級孔隙Pt/C催化劑具有較大的孔容和規整的孔道結構,其傳質性能和抗水淹性能是工業催化劑的4倍。事實上,不同類型的孔隙在ORR過程中具有特殊的作用。在ORR過程中,中孔和大孔對傳質過程中更重要,而微孔有利于容納大多數催化位點。因此ORR催化劑需同時具有多級孔結構,以保證活性位點密度和傳質效率。
為構建催化劑多級孔結構,以二氧化硅膠體、有序介孔二氧化硅、聚苯乙烯微球和其他一些氧化物為模板的犧牲模板法得到了廣泛研究和應用。例如,Liang等使用膠體二氧化硅為模板合成了比表面積高達1280 m2·g–1的氮摻雜碳催化劑,且該催化劑為具有介孔 / 微孔分布的多級孔結構材料。然而,以上的犧牲模板法的模板去除步驟可能會十分耗時,且該步驟通常需要使用強酸或強堿溶液,這對研究人員和環境可能帶來危害。為了避免這些缺點,開發了一種以NaCl重結晶為模板的形態學控制方法。在這種方法中,NaCl模板可以用熱水溶解而去除,且NaCl模板可循環使用。通過鹽重結晶,具有特殊納米結構的聚苯胺(PANI)被封裝在NaCl晶體中,然后在高溫下精確地轉化為碳納米材料(圖6)。在高溫焙燒過程中,碳納米材料在NaCl晶體封閉的納米反應器中氣化,從而產生了大量的孔。所制備的3D-Fe/N-C催化劑具有多孔隙、高活性位點利用率的特點,對ORR具有良好的催化性能。
圖6 (a)鹽重結晶法形貌固定示意圖;(b)所制的3D納米結構聚苯胺(PANI)和對應碳化產物的透射電鏡圖(TEM);(c)不同樣品的H2O2產出曲線和ORR曲線
(二)晶面工程
晶面調控是調節材料對給定反應的催化性能的一種廣泛研究的方法。由于催化反應中間產物在催化劑不同晶面的吸附強度差異很大,催化材料的反應活性與其暴露晶面高度相關。晶面通常是用Miller指數表示的。納米材料的暴露晶面與納米顆粒的形狀密切相關。一般來說,納米材料的晶面可分為低指數和高指數晶面類型。低指數晶面是指Miller指數(hkl)三個組成部分之和較小的指數晶面,而高指數晶面至少包含一個大于1的Miller指數。
低指數晶面納米材料反應性的結構敏感性在單晶Pt催化析氫反應中已經得到證實。利用掃描隧道顯微鏡(STM,圖7)證實了具有清晰表面的Pt(hkl)的表面形貌,并觀察到其活性程度在堿性溶液中遵循(110)>(100)>(111)的順序。重要的是,Pt的不同晶面的活性趨勢在堿性和酸性電解質中有很大的不同。Markovic等重點研究了Pt(111)和Pt島修飾Pt(111),證實了這種pH效應涉及HER中的結構功能關系。與原始Pt (111)表面的HER活性相比,Pt島修飾Pt(111)電極上的HER活性在堿性溶液中提高了5~6倍,而在酸性電解液中的活性僅提高了1.5倍。pH值對其活性的影響被證明是由于邊緣臺階位點解離水的特殊能力引起的。此外,Pt(hkl)的活性順序與低配位Pt原子的密度一致,這是由于低配位Pt原子加速了水的解離步驟。在非吸附性HClO4電解質中,單晶Pt不同晶面的ORR活性也觀察到類似的變化趨勢。當電解質替代為H2SO4時,Pt(100)比Pt(111)更為活躍。這種活性差異是由于硫酸氫鈉陰離子在Pt(111)上的特殊吸附行為所致。硫酸氫鈉陰離子在Pt(111)表面的吸附比在Pt(100)表面的吸附更強,導致ORR的后續步驟受阻。以上研究證實了各晶面的不同性質對其催化性能有著顯著的影響。在這項工作之后,許多研究集中在開發一種在催化表面上可控構建特定晶面的方法,以應用于理想的單晶金屬及實用的納米材料。El Sayed等首次發現了鉑納米晶體的晶面控制合成,制備得到富含(100)晶面的納米立方體、(111)晶面的納米四面體以及同時具有(111)和(100)晶面的納米球。Sun等報道了一種高溫有機相法用于合成單分散(100)端Pt納米立方體。晶面控制的Pt納米立方體在酸性電解液中的ORR活性是工業Pt催化劑活性的兩倍以上。
圖7 (a)Pt不同晶面的HER/HOR;(b)~(d)Pt不同晶面的STM(插圖為其對應的結構模型);(e)制備的Pt (111)和島狀Pt/Pt (111)表面的 STM圖;(g)兩個Pt晶面的HER活性曲線圖
由于低配位原子、臺階、邊緣和扭結的密度更高,具有高指數晶面的金屬及化合物與典型的低指數材料相比通常具有更高的反應性。然而,由于其較高的表面能,高指數晶面是熱力學上不穩定的。因此,制備高指數晶面納米材料是一項艱巨的任務。近年來,為了提高催化活性,人們開發了多種方法來合成具有高指數晶面的納米材料。Xia等開發了一種在水溶液中還原的簡單路線,以制備由(510)、(720)和(830)高指數晶面包圍的Pt凹面納米立方體(c-NCs)。利用甘氨酸控制H2PtCl6的還原動力學也可以制備得到Pt c-NCs。Sun等采用電化學方法合成了具有(730)、 (210)和(520)晶面的四面體(THH)Pt納米晶。除了單金屬材料外,多金屬高指數晶面納米晶體的合成方法也得到了開發。如圖8所示,Guo等報道了一類具有穩定高指數晶面和表面富Pt結構的新型Pt3Fe鋸齒狀納米線(z-NWs)。這些獨特的結構特征賦予了Pt3Fe z-NWs優異的ORR活性,其在0.9 V(vs. RHE)下的質量活性和比活性分別為2.11 A·mg–1和4.34 mA·cm–2。
圖8 (a)Pt-skin Pt3Fe z-NWs的高角度環形暗場(HAADF)-TEM圖;(b)、(d)圖(a)中紅色方塊區域的放大圖;(c)鋸齒狀納米線的結構示意圖;(e)商業化Pt/C、Pt3Fe z-NWs/C和Pt-skin Pt3Fe z-NWs/C的ORR質量活性圖
為了降低催化劑成本,設計和制備具有不同晶面的非貴金屬納米材料已成為晶面工程的研究熱點。Su等研究了NiO晶體的生長機制,發現NiO晶體的表面能遵循(100)< (113)<(101)≈(110)的順序。Han等提供了一種無模板水熱方法,用于可控地制備具有(001)、(112)和(001)+(111)晶面的Co3O4納米立方體(NC)、納米八面體(NTO)和納米多面體(NP)。不同的晶面賦予Co3O4納米晶表面的Co2+和Co3+活性位以不同原子結構。在含有豐富Co3+位點的還原氧化石墨烯(rGO)上,(112)晶面覆蓋的Co3O4納米顆粒對OER和ORR均表現出良好的活性。除了金屬氧化物外,許多具有特殊晶面的金屬化合物也相繼被報道。Feng等合成了具有穩定(210)面的Ni3S2納米片陣列,展現了高效穩定的HER和OER電催化性能。Pan等制得了具有不同晶體結構的花狀磷化鎳(Ni5P4和Ni2P),并證明其優異的催化活性歸因于具有高能(001)晶面的多級結構。
(三)晶相工程
除了調整納米晶體的暴露晶面外,調節原子尺度的排列(即晶相的轉變)也會使催化劑的物理和化學性質發生根本性的變化,從而影響催化劑的本征活性。具有獨特多晶相的過渡金屬二硫化物是被廣泛研究的典型案例。在這些多晶型中,亞穩態1T相由于其金屬性的性質引起了極大的研究興趣。Jin等用鋰插層法從半導體2H-MoS2合成了金屬性1T-MoS2納米片。與相應的2H晶相相比,1T-MoS2在電催化HER方面表現出顯著改善的性能(圖9)。類似地,Jin等通過更簡單的微波輔助插層法合成了金屬性1T二硫化鎢(1T-WS2)。晶相工程賦予了1T-WS2更優異的導電性和更密集的活性位點,增強了其析氫催化活性。1T催化劑不僅可以通過改變原子排列獲得獨特的性質,而且其活性中心也可能不同于傳統的2H結構相。Voiry等通過去除化學剝落的MoS2納米片表面的剩余負電荷,獲得了具有優異活性的高導電性1T-MoS2納米片。有趣的是,1T-MoS2和2H-MoS2部分氧化后,其活性變化形成鮮明對比。邊緣氧化后1T-MoS2的HER活性幾乎沒有變化,但2H-MoS2的活性卻嚴重下降。眾所周知,通常2H-MoS2晶體的邊緣是其主要的活性中心。部分氧化的1T-MoS2和2H-MoS2在HER活性上的顯著差異表明,1T-MoS2催化的主要活性中心不是納米片的邊緣,而是納米片的基面。
圖9 (a)經過鋰插層后由半導體2H-MX2到金屬態1T-MX2的相轉變;(b)兩種形態MoS2的HER極化曲線
金屬氧化物的催化性能也受其晶相影響。Wu等發現反轉尖晶石晶體結構對尖晶石的ORR催化活性有很大影響(圖10)。通過調整鐵(Fe)的含量,Co–Fe基晶體的尖晶石結構可以從正常結構變為反結構,后再變回正常結構。電化學結果表明,具有反尖晶石結構的{Co}[FeCo]O4/NG具有最好的ORR活性。DFT結果進一步揭示了反尖晶石結構的{Co}[FeCo]O4/NG的高ORR活性是由于八面體位置的Fe和Co原子的異化效應引起的氧吸附能的改變和氧-氧鍵的拉長所致。此外,晶相對ORR反應途徑的影響也有所報道。Karunagaran等合成了四種不同晶相的氧化鐵納米顆粒負載于三維rGO氣凝膠,并測定了它們催化ORR的電化學性能和電子轉移。結果表明,在高電位(0.70 V)下,四種催化劑均通過雙電子途徑催化ORR。當電位降低到0.20 V時,ORR在含磁鐵礦、磁赤鐵礦和針鐵礦的rGO復合材料通過四電子轉移動力學進行,而在含赤鐵礦的復合材料則通過兩電子轉移動力學進行。
圖10 (a)結構轉換和ORR活性之間的關系;(b){Co}[Fe2]O4/NG、{Co}[Co2]O4/NG、{Co}[FeCo]O4/NG和Pt/C的ORR活性
過渡金屬化合物的Jahn-Teller效應引起的構型畸變與其電催化性能的關系也有大量研究。Liu等通過對Co3S4/TETA雜化前驅體的超聲剝離得到原子層厚度的Co3S4納米片(CSATNs),并觀察到CSATNs產物存在明顯的結構畸變。CSATNs的結構畸變引起電子結構的改變。與塊體樣品相比[圖11(a)、(b)],CSATNs的譜圖向低磁場的偏移意味著其八面體中心(t2g4eg2)中Co3+的自旋狀態從低自旋調整到高自旋。高角度環形暗場(HAADF)圖像顯示,八面體配位陽離子僅暴露在平面中,進一步揭示了Jahn-Teller拉伸的存在[圖11(c)~(f)]。由于原子和電子結構的協同調整,CSATNs具有明顯的增強OER性能。事實上,Jahn-Teller效應是由于簡并軌道(t2g或eg)中心離子的電子分布不均勻造成的。因此,eg軌道上電子的填充態對過渡金屬化合物的催化性能有著重要的影響。Shao-Horn等進一步發現了鈣鈦礦基氧化物(ABO3)中B離子的eg軌道的填充狀態與ORR活性之間的火山關系[圖11(g)]。當鈣鈦礦型氧化物eg軌道上只有一個電子填充時(定義為eg≈1),其具有最高的ORR活性,因為此時O2可以以最佳結合能吸附在B位。雖然尖晶石的ORR活性位不是四面體位而是八面體位,但eg占有率理論也可以進一步擴展應用于尖晶石氧化物的活性描述[圖11(h)]。
圖11 (a)、(b)塊狀和Co3S4納米片的電子順磁共振圖(EPR);CSATNs的HAADF(c)和強度線(d);Jahn-Teller變形(e)和結構轉變(f)圖示;(g)鈣鈦礦氧化物的ORR活性對eg電子的函數圖;(h)在尖晶石氧化物的ORR活性中位于八面體位點的活性元素eg的作用
(四)非晶化
通過非晶化來調節原子尺度的排列,是提高材料催化性能另一個研究熱點。非晶相的短程原子排列有利于提高活性中心的密度。早在1995年,Weber等研究了非晶態化合物MoS3的結構單元,發現所有鉬都處于Mo4+氧化狀態,而硫原子則以兩種不同的配位形式存在:S2–和S22–。Hu等證實非晶態MoS2在催化HER方面更為活躍。非晶態MoSx薄膜表面極為粗糙,硫元素含量豐富,催化活性區大,活性中心密集。Benck等進一步揭示了非晶態硫化鉬的HER活性的增加是非晶態結構和納米結構所引起的大量活性位點的作用。同時,Li等從組成和結晶度方面系統地研究了非晶態MoS2催化活性的來源。有趣的是,實驗結果表明結晶度是決定催化性能的關鍵,而組成并不特別重要。
除了HER催化,Smith等基于對鐵、鎳和鈷混合金屬氧化物的研究,證明非晶態材料比晶體材料具有更佳的OER催化活性。對于非晶態結構,金屬在整體材料中的分布是均勻的,且其成分可以精確控制。以最佳元素含量配比制備的a-Fe100-y-zCoyNizOx 催化劑具有優異的催化性能,甚至可以與工業貴金屬氧化物催化劑相媲美。基于非晶態材料的組成可控的特點,可以進一步研究金屬組成以及非晶化對電催化性能的影響。Smith等制備了21個復合金屬氧化物薄膜用于電催化水氧化,并測量了每個樣品中Fe、Co和Ni的準確化學計量濃度。電化學測量證實鐵含量對降低Tafel斜率很重要,而鈷或鎳有利于降低過電位(圖12)。由于無定形態催化劑優異的催化性能,其規模化生產方法的研究十分重要。Kuai等提出了一種噴霧輔助的方法,通過這種方法可以可持續地獲得非晶混合金屬氧化物,非常適合工業應用。所制備的Fe6Ni10Ox在電化學OER中驅動10 mA·cm–2時表現出0.286 V的低過電位,且Tafel斜率僅為48 mV·decade–1,優于所有研究的Fe-Ni-Ox 催化劑的催化性能。
圖12 不同金屬成分的無定形金屬氧化物薄膜活性參數的等高線。
(a)起始電位;(b)塔菲爾曲線;(c)j=0.5 mA·cm–2時的過電位
雖然非晶態工程可以大大提高催化劑的活性位密度,但由于晶體結構的短程無序,非晶態材料的導電性會降低。將低導電非晶態材料與高導電材料復合是保證非晶催化劑優良電催化性能的有效途徑。Lee等合成了以低成本、高導電性的Ketjenback(KB)碳負載非晶MnOx納米線作為高效ORR電極,大大加速了電催化過程中的電子轉移。許多其他非晶態/導電復合材料,如非晶態MoSx/碳復合催化劑、非晶態MoSx/聚吡咯共聚物薄膜(PPy/MoSx)和非晶態MoSx/氮摻雜碳納米管催化劑(NCNT)也被報道。這些復合材料中的高導電骨架可以克服非晶態催化劑的低導電性引起的障礙,從而顯著提高催化活性(圖13)。多孔金屬納米結構,如鎳泡沫和納米多孔金,也被用作支持非晶態MoSx催化劑的導電基底,以顯著增強其HER活性。
圖13 (a)MoSx/NCNT森林狀雜化催化劑的HER示意圖;(b)不同樣品的HER活性曲線
(五)缺陷工程
缺陷普遍存在于納米材料中。人們已經認識到,缺陷催化劑表面總是比無缺陷催化劑表現出更高的反應活性。因此,缺陷工程逐漸發展成為調整納米材料電子和表面性質的有效方法。
Cheng等通過在環境條件下水溶液中還原非晶態二氧化錳,合成了四方或立方MxMn3–xO4尖晶石。納米MxMn3–xO4由于其高活性面積和豐富的缺陷,對ORR和OER都具有相當高的催化活性。同樣,Qiao等合成了富氧空位(OV)缺陷的介孔MnCo2O4材料,發現其穩定性和耐甲醇性能甚至超過了Pt/C催化劑。為了深入了解缺陷對催化性能的影響,Li等應用DFT+U計算研究了OV濃度對β-MnO2催化劑電子結構及其ORR的催化性能的影響。如圖14所示,電子結構與OV濃度的曲線關系表明,OV濃度可以調節β-MnO2的電導率和ORR催化活性。適當濃度的OVs將大大提高MnO2的電導率,而過量的OVs將阻礙ORR過程。缺陷工程也可用于提高納米材料催化活性位點的密度。Xie等設計了一種高濃度前驅體、不同硫脲用量的反應,實現了對所制備超薄MoS2納米片缺陷的可控調制。由于其富含缺陷的結構,MoS2納米片表面形成了許多細小的裂紋,使得其活性位點數量是無缺陷MoS2的13倍。
圖14 (a)不同OV濃度下MnO2的活性趨勢;(b)DFT計算各性質結果隨OV濃度的改變
與金屬化合物中的空位類似,碳基電催化劑中的固有缺陷是普遍存在的,但長期以來卻一直被忽略。通常,碳材料經過雜原子摻雜后容易形成缺陷,成為有利于電催化的活性中心。然而,雜原子摻雜碳基材料的電催化活性主要歸因于雜原子摻雜的誘導效應。隨著時間的推移,一些研究發現,具有本征缺陷的碳電催化劑的催化活性甚至優于雜原子摻雜碳材料。
Hu等發現缺陷碳納米籠(CNC)具有比硼摻雜碳納米管更高的ORR活性。Hu等成功地合成了缺陷豐富的CNC,該材料具有許多典型的缺陷位置,但沒有任何摻雜劑[圖15(a)]。電化學結果表明,缺陷密度最高的CNC材料表現出最好的ORR電化學活性[圖15(c)]。DFT結果進一步表明,這些缺陷材料的高ORR活性可歸因于五邊形和鋸齒形邊緣缺陷[圖15(d)]。Yao等利用第一性原理計算,預測了石墨烯上585種缺陷的ORR活性甚至超過了氮摻雜位點,并通過實驗研究為這一理論預測提供有力支持。考慮到缺陷機制,Yao等通過在950 ℃下碳化Zn-MOF制備了一種無元素摻雜的多孔碳(PC)材料。通過去除鋅原子,可以在PC催化劑上形成缺陷,使PC催化劑不僅具有優異的ORR活性,而且具有與商業Pt/C催化劑相當的穩定性。此外,除ORR過程外,在從氫-水轉化系統中其他三種電化學反應(即HOR、OER和HER)的電催化活性被證明對石墨烯中的缺陷類型特別敏感。
圖15 CNC700的高倍透射電鏡圖(a)和結構示意圖(b);(c)CNC樣品的旋轉圓盤電極(RDE)ORR活性曲線;(d)不同缺陷的ORR步驟的自由能圖
(六)原子摻雜
原子摻雜是調節催化材料性能最常用的策略。通過合理地將一個或多個金屬或非金屬元素引入材料的晶格中,可以調節原材料的電子結構,從而有效地提高材料的催化性能。以MoS2為例,多種金屬元素如Ni、Co、Fe、V、Li和Cu被成功摻雜到其晶體結構中,有效改善了其物理和化學特性。在這些摻雜的金屬元素中,Ni和Co傾向于摻雜在MoS2中S元素的附近,這將降低S邊緣的氫吸附能,增加MoS2材料中活性位點的密度。與Ni和Co的摻雜不同,V摻雜不能增加活性位點的數量,但會增強MoS2的導電性。
Xiong等通過結合實驗和理論計算,探討了碳化鉬中鎳的摻雜對其表面電子結構的影響及與其催化性能之間的關系。如圖16(a)~(d)所示,通過水熱和碳化處理,一維NiMo2C納米線陣列直接構建在導電泡沫鎳上(NiMo2C/NF)。與Mo2C和Ni催化劑相比,這種無黏結劑的NiMo2C/NF集成電極顯示出更優異的催化活性[圖16(e)]。DFT計算結果表明,Ni與Mo2C晶格的結合改變了催化劑的電荷分布,產生了Ni與Mo2C的協同效應,從而降低了氫結合能[圖16(f)、(g)]。除了金屬元素,非金屬元素摻雜的研究也非常活躍。Xie等成功合成了氧摻雜MoS2超薄納米片,可以協同調控其活性位點和導電性。DFT計算結果顯示,含氧MoS2的微分結合能更小,其驅動HER過程的能壘更低。Zhang等通過部分磷化金屬氧化物前驅體,構建了氧摻雜NiMoP2(O-NiMoP2)。如圖16(h)~(i)所示,氧的摻入優化了NiMoP2表面的氫吸附能,其ΔGH*比未摻雜樣品更接近于零。此外,O-NiMoP2中的Ni和Mo帶有更多的正電荷,這有利于水分子的吸附和活化,極大加速了水在堿性介質中的解離。
圖16 (a)~(d)NiMo2C電極的掃描電鏡、透射電鏡圖和元素能譜圖;(e)NiMo2C電極的電化學析氫活性曲線;Mo2C(001)(f)和NiMo2C(001)(g)的Bader電荷分布圖;不同NiMo基樣品的氫自由能(h)和電荷密度分布(i)圖
除了金屬化合物,碳基材料也被廣泛用作摻雜目標,極大地擴大了催化劑的研究范圍。2013年,Li等報道了一種磷摻雜石墨烯,其ORR催化性能與商業用Pt/C相當。隨后,Li等進一步制備了氮磷雙摻雜石墨烯材料作為ORR和OER的電催化劑,其催化活性超過了商業Pt/C催化劑。為了揭示雜原子摻雜碳高活性的起因,Yang等對一系列不同雜原子摻雜的石墨烯進行了全面的DFT計算。DFT結果表明,摻雜碳催化劑存在三重效應,即電荷、自旋密度和配體效應決定了摻雜碳催化劑的本征催化活性及 ORR機制(圖17)。當碳材料被單一雜原子摻雜時,摻雜原子周圍的碳位只能被單一效應激活。這導致ORR 通過結合機制進行,并且存在不低于0.44 V本征過電位限制。當碳材料被金屬或雙雜原子摻雜時,雙碳位可以被三重效應激活,其ORR遵循離解機制。此時,結合機制的活性限制將不再有效,從而ORR活性可得到有效增強。Huang等合成了金屬和非金屬元素共摻雜的石墨烯,并揭示了氮摻雜石墨烯中的氮結構和微量金屬原子對HER催化的作用。該研究發現,季銨態氮是氮摻雜石墨烯中三種摻雜氮類型中最活躍的位點。而當摻雜微量鈷原子時,平面氮的活性最強;當微量鈷原子被鎳取代時,平面氮的活性則被抑制。
圖17 (a)碳活性位點的ORR過電位對ΔGOOH*函數圖;ΔGOOH*對電荷效應(b)、配體效應(c)和自旋密度關系(d)圖
(七)界面工程
雜化納米材料擁有一個位于兩個組分的邊界的界面。對于多相催化劑來說,具有適當的界面結構是極其重要的,因為界面區域總是呈現出獨特的物理和化學性質。這些獨特的性質可以促進材料結合、轉化和運輸表面物種的能力,極大促進了發生在其表面的催化反應。近年來,有大量的研究通過界面工程設計與合成催化劑用于氫-水轉化。
一般來說,根據組分的相對位置,雜化材料可分為支撐結構、異質結構或核殼結構。支撐結構的特點是支撐組分比其他組分大得多,而異質結構材料中的組分尺寸相似。在核殼結構中,一個組分被另一個組分覆蓋,在兩個組分之間的邊界處存在界面。這三種具有不同界面結構的雜化材料是近年來研究金屬、金屬氧化物、非氧化物等組裝的典型結構。例如,Feng等通過控制鎳原子在煅燒過程中向外擴散,合成了一種MoNi4固定在MoO2長方體上的支撐結構電催化劑(MoNi4/MoO2@Ni),在堿性溶液中表現出優異的HER活性[圖18(a)、(b)]。Xue等通過將金屬鈷逐漸磷化為CoP制備了異質結構Co/CoP納米顆粒。通過改變NaH2PO2和Co元素的比重,異質Co/CoP納米顆粒中的CoP含量能夠可控調節,進而改變Co/CoP催化劑的界面區[圖18(c)~(f)]。如圖18(g)~(h)所示,Li等通過對雙金屬(Ni,Co)有機骨架進行碳化還原和可控氧化煅燒,制備了由碳限域NiCo@NiCoO2納米顆粒組成的多孔納米陣列(NiCo@NiCoO2/C PMRAs)。所制得的NiCo@NiCoO2/C PMRAs包含了催化OER所需的幾種特性,包括大的表面積、良好的導電性和豐富的電催化活性位點。
圖18 (a)、(b)MoNi4/MoO2@Ni的典型SEM圖;(c)制備樣品的電流密度;(d)Co/CoP-5納米顆粒的組成曲線;(e)金屬Co、CoP和基 Co/CoP的Mott-Schottky接觸的電子結構;(f)Co/CoP-5納米顆粒的HRTEM圖;NiCo@NiCoO2/C PMRAs的制備過程(g)和HRTEM圖(h)
為了更合理地設計催化劑,對具有豐富界面的雜化材料的催化性能提升原因也進行了深入研究。其中,雜化材料中界面位點的電子結構調控已被充分證實。Yu等用X射線吸收近邊光譜(XANES)觀察到了Ni(OH)2/Pt催化劑的電子轉移。在α-和β-Ni(OH)2/Pt電極上Ni的前邊緣和主吸收邊緣均向低能方向移動,說明電子從Pt基底向氫氧化物轉移。
Hu等揭示了Pt/CoS2雜化體系中CoS2和Pt在水電解反應中的強金屬載體相互作用(SMSI)。DFT計算預測了Pt的d帶結構向下移動,這也進一步被X射線光電子能譜(XPS)和X射線吸收精細結構(XAFS)所證實。盡管電子轉移在金屬/金屬復合催化劑中已經得到了很好的證明,但其高催化活性的潛在機制尚不明確。為了揭開這個謎團,Peng等研究了金屬/金屬氧化物界面的化學性質,發現了一種界面誘導的協同效應——“煙囪效應”[圖19(a)、(b)]。DFT計算結果表明[圖19(c)、(d)],界面附近的位點對H2O*和OH*物種不吸附,而只選擇性地吸附H*,這有效地避免了H2O*和OH*對活性位點的毒害作用。同時,界面上的活性位上H*反應物種的ΔGH*接近于0,說明其對H*反應物種的吸附和解吸能力良好。結合以上特點,析氫反應在金屬氧化物 / 金屬催化劑界面處連續進行,形成了類似于連續產氫的煙囪。此外,金屬氧化物 / 金屬復合材料的HER活性與界面金屬原子之間呈正相關[圖19(e)],說明可以通過增加界面活性位點的數量從而加速析氫過程。除金屬/金屬復合催化劑外,Peng等還通過制備單金屬NiONi3S2異質節納米片進一步研究了金屬/金屬復合催化劑性能提高的根源。NiO-Ni3S2界面處Ni–S鍵向Ni–O鍵的電子轉移導致了其比基準Pt/C和RuO2催化劑具有更好的電解水活性[圖19(g)]。DFT計算結果表明,NiO-Ni3S2界面上氫(或含氧)中間體的活化勢壘顯著降低,說明界面活性位點具有優異的OER和HER本征活性[圖19(h)、(i)]。
圖19 (a)RuO2/Ni復合催化劑中兩種可能的HER路徑圖示;(b)在金屬/金屬氧化物界面處的“煙囪效應”;(c)ΔGH*對氫吸附自由能的曲線;(d)不同團簇上H2O*、OH*和H*物種的吸附能;(e)NiO/Ni樣品HER活性隨Niinterface含量的改變趨勢;(f)單金屬NiO-Ni3S2雜化納米片的水裂解圖示;(g)NiO-Ni3S2及Pt/C和RuO2電極組合的水裂解極化曲線;Ni3S2和O-Ni3S2表面的氫吸附自由能(h)和OER各步的反應自由能圖(i)
空位形成是界面材料的催化性能提升的另一個重要因素。Xi等報道了一個典型FeS2/CoS2雜化納米片(FeS2/CoS2-NSs)用于催化水電解。在合成過程中,通過采用共沉淀法制備了CoFe2O4納米粒子,后通過硫化將其轉化為FeS2和CoS2相,并產生包含缺陷位點的界面。電子順磁共振(EPR)譜顯示,FeS2/CoS2-NSs復合材料在g=2.007處具有較強的EPR信號,這表明其具有豐富的S空位。擴展X射線吸收精細結構(EXAFS)進一步研究樣品的局部結構,檢測到FeS2/CoS2-NSs中Fe的K邊EXAFS的峰強度明顯降低,這說明了Fe的配位缺陷。Qu等在具有嵌入式結構CeO2/NiO(Ce-NiO-E)或表面負載結構CeO2/NiO(Ce-NiO-L)發現了類似的現象。NiO(Ni3+:62%,氧缺陷:24%)、Ce-NiO-L(Ni3+:69%,氧缺陷:26%)和Ce-NiO-E(Ni3+:71%,氧缺陷:32%)中的Ni3+和氧缺陷的增加趨勢與活性趨勢密切相關,表明界面區的空位對活性的增強有很大貢獻。事實上,界面材料的電子結構調控和空位并不獨立存在,界面材料的催化性能可能同時受到這兩個因素的影響。
(八)合金化
合金化是兩種或兩種以上金屬的金屬原子相互擴散滲透,或通過熔化、燒結或氣相沉積過程將非金屬元素添加到金屬中。合金化是提高金屬催化劑性能的有效策略,它不僅可以細化晶粒尺寸,提高機械強度以及催化劑的比表面積,還可選擇性地減少單一組分的用量,以降低催化劑的成本。此外,由于組分之間的協同作用,通過加入其他元素形成合金,可以改變金屬的催化活性和選擇性。根據Brewer-Engel價鍵理論,將具有未填充d軌道的金屬和具有內部成對d電子的金屬合金化可以調節合金表面的氫吸附能,從而提高析氫活性。Raj等采用電沉積技術制備了一系列鎳基二元復合材料,在堿性溶液中的HER催化活性變化趨勢是:Ni-Mo>Ni-Zn>NiCo>Ni-W>Ni-Fe>Ni-Cr。Ni-Mo合金因其優異的催化活性被認為是最有前途的HER催化材料。Zhang等利用磁控濺射技術在鎳基表面成功地構建了一層尺寸均勻、元素分布均勻的Ni-Mo合金納米棒,并發現其交換電流密度幾乎是單金屬催化劑的10倍。研究表明,Ni-Mo合金電極優異的催化活性主要來自兩個方面:①在生長過程中,雙組分金屬的晶粒細化導致比表面積增加;②元素Ni和Mo的電負性差異導致電子在Mo周圍聚集,從而形成電催化的協同作用。
為了減少貴金屬的使用,許多非貴金屬(Co、Ni、Fe、Cu、V、Cr、Mn、Zn等)被用來與貴金屬結合形成合金作為電催化劑。對不同PtM合金的ORR性能研究表明,其活性順序為:PtFe/C>PtCo/C>PtV/C>PtNi/C>Pt/C,穩定性趨勢為:Pt3Ir (111) >Pt3Co (111) >Pt3Ni (111) >Pt3Fe (111)。此外,Stamenkovic等根據鉑合金的ORR活性與3d金屬的d帶中心位置,發現了典型的火山關系(圖20)。研究表明,Pt3M催化劑的ORR機制是O2解離或質子/電子轉移到O2分子上,最佳ORR催化劑的氧結合能應比Pt弱。Bampos等在酸性溶液中進一步合成了一系列碳負載Pd-M(其中M=Ag、Co、Cu、Fe、Ni或Zn)雙金屬催化劑,其活性變化趨勢為:PdZn/C>PdNi/C>Pt/C>PdAg/CPdCo/C>PdFe/C>PdCu/C>Pd/C。其中,最優的PdZn/C在0.35~0.5 V(vs. Ag/AgCl)電壓下的 ORR比活性比Pt/C高3倍。除了金屬元素外,引入非金屬元素同樣可以提高合金的催化性能。Sampath等制備了少層MoS2(1–x)Se2x合金,其活性高于原始MoS2MoSe2。通過調節MoS2(1–x)Se2x中Se/S的摻入比例,系統地研究了催化劑的構效關系,并發現MoS1.0Se1.0S顯示了最高的HER活性。Gong和Xu課題組通過對Mo-S-Se合金的研究,發現了類似結果。He等成功地控制了碳纖維上三元WS2(1–x)Se2x納米管中硫和硒的組成,所造成的無序原子排列使WS2(1–x)Se2x具有優異的電催化性能。Jin等進一步獲得了三元黃鐵礦型CoPS用于光/電化學析氫反應。由于CoPS中P2–配體具有更高的給電子性質,該三元黃鐵礦CoPS具有更適中的氫吸附能力,使得其活性高于CoS2。
圖20 (a)測試所得動力學電流密度和計算所得氧吸附能ΔEO之間的關系;(b)鉑基合金表面鉑的ΔEO對合金能量圖
四、結論與展望
電化學氫-水轉化過程中的大部分能量耗散是由能源系統中的驅動電化學反應的活化能引起的。由于催化材料對反應活化能的重要影響,催化材料是高效能源系統的核心。為了實現一個高效、可持續的能源系統,迫切需要加快開發低成本、高活性的電催化劑。
一般來說,催化劑的性能取決于兩個主要因素:①給定區域內活性位點的數目;②每個活性位點的本征活性。調整幾何結構可有效地增加活性位點的密度。當催化劑尺寸減小到納米尺度時,催化劑具有高的比表面積,并且增加催化活性晶面的暴露。缺陷工程和非晶化也可以通過暴露熱力學不穩定活性位或不飽和原子位點來增加活性位點的數量。提高活性位點的本征活性是提高活性的一個更基本但更困難的策略,因為這涉及對催化材料電子結構的精確調節。本征活性的優化需要對反應的特性有基本理解和對具有目標功能的催化劑的設計有深刻的見解。
文章所討論的典型實例(其催化性能總結見表2至表4)應用理論與實驗研究相結合,通過元素摻雜、界面工程、晶相工程、合金化等手段,成功地調節了催化劑的本征活性。
表2 典型HER催化劑性能
表3 典型OER催化劑性能
表4 典型非貴金屬ORR催化劑性能
表5 典型貴金屬ORR催化劑性能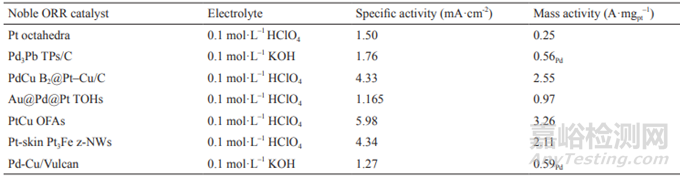
目前,隨著化學合成技術的飛速發展,許多催化材料以其優異的電催化性能被報道。同時,物理表征方法和理論計算的發展也為研究人員提供了更多的依據和指導,使我們更好地了解催化劑的性能提升的機制。然而,現在電極催化劑的生產仍主要是通過傳統的試錯工藝,而不是通過合理的設計。這種研究模式不僅浪費了社會資源和科研人員的精力,而且極大地延緩了科學發展。因此,迫切需要從最基本的層面發展一種面向性能的電催化劑設計策略,并使之能應用于實際的催化劑設計合成中。
這個目標需要計算化學、電催化化學和合成化學協同工作;然而不幸的是,目前這三個領域都需要改進。目前的理論計算模型還不完善,因為大多沒有考慮離子強度、雙層效應、溶劑化效應等因素的影響,難以準確反映催化材料表面的實際反應過程。此外,盡管這些氫和氧參與反應的機制已經被廣泛研究,但在不同催化劑表面上的實際反應機制仍然是個謎。事實上,由于大多數催化劑的表面結構在電催化過程中一直在變化,因此很難確定實際的活性中心。先進的理論計算和實驗表征的結合將帶來新的進展,這將有助于我們在分子水平上理解電化學反應機制和催化劑的動態演化。
最后,面向功能的催化劑制備仍是一個重大挑戰。現有的材料合成技術能夠在納米尺度上對特定催化劑的理化性質進行一定程度的調控,但利用可控合成技術在原子尺度上調控催化劑的電子結構還不成熟。發展適用性強、規模化生產的可控合成方法是未來研究的另一個熱點。
改編原文:
Lishan Peng, Zidong Wei. Catalyst Engineering for Electrochemical Energy Conversion from Water to Water: Water Electrolysis and the Hydrogen Fuel Cell[J]. Engineering,2020,6(6):653-679.






























