摘 要|Abstract
國(guó)際標(biāo)準(zhǔn)化組織(ISO)于2022 年4 月19 日發(fā)布全球首個(gè)專門針對(duì)新型冠狀病毒核酸檢測(cè)的國(guó)際標(biāo)準(zhǔn)——ISO/TS 5798:2022《體外診斷檢驗(yàn)系統(tǒng)——核酸擴(kuò)增法檢測(cè)新型冠狀病毒(SARSCoV-2)的要求及建議》。本文對(duì)該標(biāo)準(zhǔn)通用要求部分進(jìn)行分析及研究,并與我國(guó)2021 年11 月26 日發(fā)布的GB/T 40982—2021《新型冠狀病毒核酸檢測(cè)試劑盒質(zhì)量評(píng)價(jià)要求》進(jìn)行比對(duì),以期為我國(guó)體外診斷試劑開(kāi)發(fā)商、制造商,以及SARS-CoV-2 研究和診斷機(jī)構(gòu)提供參考。
The first international standard specifically for nucleic acid testing of COVID-19—In vitro diagnostic test systems-Requirements and recommendations for detection of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) by nucleic acid amplification methods (ISO/TS 5798:2022) was published by International Organization for Standardization (ISO) on April 19,2022. This paper analyzes and researches on the general requirements of ISO/TS 5798:2022, and compares it with the Quality assessment requirements for severe acute respiratory syndrome coronavirus 2 nucleic acid detection kit (GB/T 40982—2021) released on November 26, 2021. This paper aims to provide reference for the in vitro diagnostic developers and manufacturers, as well as institutions and organizations supporting SARS-CoV-2 research and diagnostics in China.
新型冠狀病毒(SARSCoV-2)是目前已知的第七種感染人類的冠狀病毒[1]。冠狀病毒是一種廣泛分布于動(dòng)物界的有包膜RNA 病毒,已在人類和其他哺乳動(dòng)物以及鳥類中發(fā)現(xiàn)。冠狀病毒之所以被如此命名,是因?yàn)樵陔娮语@微鏡下觀察時(shí),可見(jiàn)病毒表面刺突蛋白所構(gòu)成的形似光暈的棒狀突起, 這些刺突蛋白能夠促進(jìn)病毒附著和進(jìn)入細(xì)胞。冠狀病毒大致呈球形,直徑為118~136nm, 其基因組大小在26~32kb 之間, 是目前已知RNA 病毒中最大的病毒。由SARS-CoV-2 引起的疾病被世界衛(wèi)生組織(WHO)命名為COVID-19[2]。
SARS-CoV-2 可通過(guò)飛沫和氣溶膠傳播,也有可能通過(guò)與無(wú)癥狀或有癥狀感染者接觸等方式傳播,并在上呼吸道和下呼吸道中復(fù)制。與嚴(yán)重急性呼吸綜合征(SARS)和中東呼吸綜合征(MERS)類似,已報(bào)告發(fā)生超級(jí)傳播事件。大多數(shù)感染并不復(fù)雜,5%~10% 患者住院治療主要是由于肺炎和其他嚴(yán)重炎癥,呼吸系統(tǒng)和多器官衰竭等并發(fā)癥的發(fā)生風(fēng)險(xiǎn)會(huì)隨著年齡的增長(zhǎng),以及患有高血壓、糖尿病、慢性心血管疾病、慢性肺部疾病以及免疫缺陷病而增加。
不可否認(rèn),現(xiàn)階段COVID-19 仍然是國(guó)際關(guān)注的公共衛(wèi)生事件,特別是可能出現(xiàn)SARS-CoV-2 新變異株和國(guó)際傳播,繼續(xù)對(duì)全世界人民帶來(lái)健康威脅。目前雖然有些國(guó)家和地區(qū)已經(jīng)取消對(duì)新冠防控的各種限制,但正如WHO 總干事譚德塞在2022 年9 月22 日媒體通報(bào)會(huì)上的講話,大流行尚未結(jié)束,終點(diǎn)已經(jīng)在望,但能夠看到終點(diǎn)并不意味著已經(jīng)到達(dá)終點(diǎn),病毒仍在傳播,仍在變化,出現(xiàn)更危險(xiǎn)變異株的風(fēng)險(xiǎn)始終存在[3]。
疫情發(fā)生至今,各國(guó)均認(rèn)識(shí)到,與研發(fā)疫苗和藥物同等重要的,是需要具備快速識(shí)別、檢測(cè)、隔離和治療COVID-19 患者并對(duì)接觸人群進(jìn)行檢疫以控制傳播的能力。COVID-19 的臨床管理及SARS-CoV-2 感染和傳播的防控需要準(zhǔn)確高效的體外診斷。現(xiàn)階段已有不少檢測(cè)SARSCoV-2 的方法和試劑盒,且更精準(zhǔn)高效的檢測(cè)手段還在持續(xù)增加。當(dāng)前SARS-CoV-2 最主要的2種檢測(cè)路徑,分別是基于分子學(xué)的熒光PCR 方法的核酸檢測(cè)和基于免疫學(xué)的SARS-CoV-2 抗原檢測(cè)。抗原檢測(cè)速度快、成本低,但有一定漏檢率,結(jié)果需要確認(rèn)測(cè)試;而核酸檢測(cè)準(zhǔn)確性高、特異性強(qiáng),是目前SARS-CoV-2檢測(cè)的金標(biāo)準(zhǔn)。
由此可見(jiàn), 持續(xù)設(shè)計(jì)、開(kāi)發(fā)和建立更加精準(zhǔn)高效的SARS-CoV-2 核酸檢測(cè)方法是COVID-19 防控的關(guān)鍵環(huán)節(jié),也是為今后突發(fā)公共衛(wèi)生安全事件應(yīng)對(duì)儲(chǔ)備標(biāo)準(zhǔn)與方法成果。在檢測(cè)方法及試劑盒的開(kāi)發(fā)和日常應(yīng)用過(guò)程中,應(yīng)建立其綜合質(zhì)量評(píng)價(jià)指標(biāo),確保檢測(cè)結(jié)果的準(zhǔn)確性。為此, 國(guó)際標(biāo)準(zhǔn)化組織(ISO)于2022 年4 月19 日正式發(fā)布全球首個(gè)專門針對(duì)SARS-CoV-2檢測(cè)的國(guó)際標(biāo)準(zhǔn)——ISO/TS5798:2022《體外診斷檢驗(yàn)系統(tǒng)—— 核酸擴(kuò)增法檢測(cè)新型冠狀病毒(SARS-CoV-2) 的要求及建議》[In vitro diagnostic test systems-Requirements and recommendations for detection of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)by nucleic acid amplification methods][4]。本文主要對(duì)該標(biāo)準(zhǔn)通用要求部分進(jìn)行分析及研究,同時(shí)與國(guó)家市場(chǎng)監(jiān)督管理總局和國(guó)家標(biāo)準(zhǔn)化管理委員會(huì)于2021年11 月26 日聯(lián)合發(fā)布的GB/T40982—2021《新型冠狀病毒核酸檢測(cè)試劑盒質(zhì)量評(píng)價(jià)要求》[5]國(guó)家標(biāo)準(zhǔn)進(jìn)行比對(duì),以期為我國(guó)體外診斷試劑開(kāi)發(fā)商、制造商,以及SARS-CoV-2 研究和診斷機(jī)構(gòu)及組織提供參考。
1、 ISO/TS 5798:2022通用要求概述
ISO/TS 5798:2022 為采用核酸擴(kuò)增技術(shù)檢測(cè)SARSCoV-2 分析測(cè)試的程序步驟、設(shè)計(jì)開(kāi)發(fā)、驗(yàn)證確認(rèn)、生產(chǎn)轉(zhuǎn)化和實(shí)施使用等提出要求和建議。該標(biāo)準(zhǔn)中詳細(xì)規(guī)定了采用核酸擴(kuò)增試驗(yàn)(NAAT) 進(jìn)行SARSCoV-2 分子檢測(cè)的流程。
1.1 檢測(cè)前程序
檢測(cè)前程序包括臨床樣本采集、運(yùn)輸、儲(chǔ)存、樣本溶解、核酸提取和濃縮。一般應(yīng)考慮:使用適當(dāng)?shù)膫€(gè)人防護(hù)設(shè)備(PPE);參考SARS-CoV-2 相關(guān)暴露或感染特點(diǎn)確定樣本類型選擇;根據(jù)所選樣本類型,按照規(guī)范要求采集樣本;樣本在包裝、運(yùn)輸和儲(chǔ)存時(shí),應(yīng)采取適當(dāng)?shù)纳锇踩胧⒖紤]對(duì)病毒核酸降解的影響;在實(shí)驗(yàn)室檢測(cè)前,所有樣本的初始處理(滅活前)應(yīng)在經(jīng)過(guò)驗(yàn)證的生物安全柜或封閉裝置中進(jìn)行。
1.2 檢測(cè)程序
檢測(cè)程序包括逆轉(zhuǎn)錄(cDNA合成)和適當(dāng)?shù)臄U(kuò)增方法。為避免交叉污染,所有檢測(cè)活動(dòng)均應(yīng)使用單獨(dú)的設(shè)備和(或)一次性用品,實(shí)驗(yàn)人員做好個(gè)人防護(hù);樣本提取、反應(yīng)試劑制備和擴(kuò)增處理應(yīng)在單獨(dú)的實(shí)驗(yàn)室進(jìn)行,即使全自動(dòng)化的分析檢測(cè)也需要專用區(qū)域,避免在不同工作區(qū)移動(dòng)儀器或共用設(shè)備;除非用于擴(kuò)增后步驟,否則應(yīng)盡量避免打開(kāi)管蓋;在進(jìn)行檢測(cè)時(shí),應(yīng)嚴(yán)格遵守核酸擴(kuò)增法檢測(cè)實(shí)驗(yàn)室的分區(qū)要求;可以將脫氧尿苷三磷酸(dUTP)和尿嘧啶-DNA 糖基化酶(UDG)加入反應(yīng)混合液中,以消除擴(kuò)增子污染;樣本檢測(cè)過(guò)程中應(yīng)考慮廢物的臨時(shí)儲(chǔ)存和處置問(wèn)題,如果保存有價(jià)值的生物樣本材料,可考慮建立生物庫(kù)。另外,實(shí)驗(yàn)室應(yīng)建立信息系統(tǒng),用于采集、處理、記錄、報(bào)告、存儲(chǔ)或檢索有關(guān)檢測(cè)和檢測(cè)前數(shù)據(jù)及相關(guān)信息。
1.2.1 計(jì)量學(xué)溯源
標(biāo)準(zhǔn)品應(yīng)可溯源至已驗(yàn)證的SARS-CoV-2 標(biāo)準(zhǔn)物質(zhì), 如WHO 關(guān)于SARS-CoV-2 標(biāo)準(zhǔn)品[6] 或適當(dāng)?shù)牡韧镔|(zhì),也可根據(jù)外部質(zhì)量保證計(jì)劃對(duì)試驗(yàn)進(jìn)行驗(yàn)證。不同來(lái)源的標(biāo)準(zhǔn)物質(zhì)檢測(cè)結(jié)果應(yīng)一致。標(biāo)準(zhǔn)物質(zhì)應(yīng)在規(guī)定的溫度和條件下儲(chǔ)存和處理,并在失效日期前使用,否則會(huì)影響檢測(cè)結(jié)果。實(shí)驗(yàn)室可按照要求制備內(nèi)部參考品,用于制備標(biāo)準(zhǔn)物質(zhì)的材料應(yīng)包括與檢測(cè)樣本相同類型或具有相同成分的物質(zhì),以及滅活的SARS-CoV-2 或假病毒;滅活病毒或制備的假病毒應(yīng)在通過(guò)參考測(cè)量程序確定濃度后使用,例如采用經(jīng)驗(yàn)證的定量方法,如數(shù)字PCR(dPCR)測(cè)定濃度以確保結(jié)果的準(zhǔn)確性。應(yīng)明確規(guī)定內(nèi)部制備的標(biāo)準(zhǔn)物質(zhì)的儲(chǔ)存條件和時(shí)間,并對(duì)其進(jìn)行驗(yàn)證,以避免目標(biāo)核酸的損失。
1.2.2 陽(yáng)性閾值
對(duì)于PCR 核酸擴(kuò)增方法,陽(yáng)性閾值是指Cq 臨界值,可確定目標(biāo)核酸是否存在,并定義哪些檢測(cè)結(jié)果報(bào)告為“已檢出”,哪些檢測(cè)結(jié)果報(bào)告為“未檢出”。設(shè)置合適的陽(yáng)性閾值關(guān)系到檢測(cè)的臨床特異性和臨床靈敏度。對(duì)擴(kuò)增信號(hào)放大的確認(rèn)可用于結(jié)果解釋。Cq 值應(yīng)與擴(kuò)增曲線的形狀相比較。在沒(méi)有 SARS-CoV-2RNA 的情況下,經(jīng)過(guò)設(shè)計(jì)和優(yōu)化的SARS-CoV-2 PCR 將不會(huì)產(chǎn)生Cq 信號(hào)。任何區(qū)分陰性和陽(yáng)性結(jié)果的Cq 臨界值都應(yīng)通過(guò)臨床樣本進(jìn)行驗(yàn)證。高Cq 值用于排除由于病毒量低或非特異性擴(kuò)增引起的極低信號(hào)。應(yīng)注意,除非結(jié)果具有一致性,否則不同實(shí)驗(yàn)室的Cq 值不應(yīng)直接比較,應(yīng)使用有證標(biāo)準(zhǔn)物質(zhì)進(jìn)行比較。
1.2.3 包裝和使用說(shuō)明
所使用的試劑盒包裝應(yīng)完好無(wú)損,標(biāo)簽清晰并注明產(chǎn)品名稱、批號(hào)、內(nèi)容物、有效期、貯存條件等情況。使用說(shuō)明應(yīng)詳細(xì)列出應(yīng)用的預(yù)期用途和處理程序,包括目標(biāo)用戶、應(yīng)用領(lǐng)域、檢測(cè)結(jié)果解釋、處理程序和注意事項(xiàng)。
1.3 檢測(cè)后程序
檢測(cè)后程序包括廢物管理和檢測(cè)結(jié)果報(bào)告等。由于SARSCoV-2 具有致病性,因此任何情況下都應(yīng)遵循生物風(fēng)險(xiǎn)管理程序,并在完成實(shí)驗(yàn)室檢測(cè)后恰當(dāng)執(zhí)行以下程序:剩余臨床樣本的保存和處理;擴(kuò)增后廢棄樣品的處理;實(shí)驗(yàn)室和設(shè)備的清潔和凈化;擴(kuò)增后產(chǎn)物的儲(chǔ)存和處置。
實(shí)驗(yàn)室檢測(cè)后應(yīng)提供相應(yīng)的檢測(cè)報(bào)告,檢測(cè)報(bào)告的內(nèi)容應(yīng)至少包含以下信息:必要的樣本信息、檢測(cè)樣本種類、檢測(cè)方法、樣本采集時(shí)間、貯存和運(yùn)送時(shí)間及條件、報(bào)告發(fā)布時(shí)間、檢測(cè)結(jié)果的判斷和解釋信息、結(jié)果審核和授權(quán)發(fā)布人員信息。
1.4 質(zhì)量評(píng)價(jià)體系
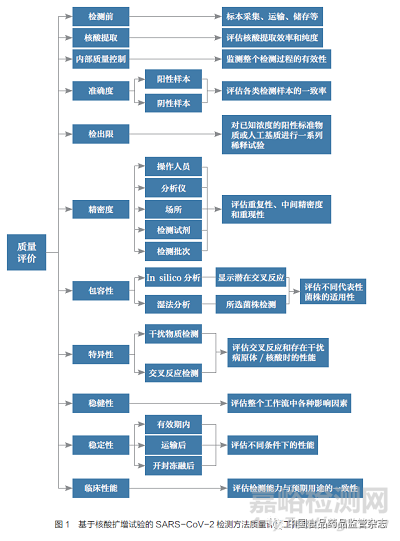
ISO/TS 5798:2022 明確了準(zhǔn)確性、檢出限、包容性、特異性、穩(wěn)健性等病毒檢測(cè)的性能驗(yàn)證評(píng)價(jià)指標(biāo),全面構(gòu)建了SARSCoV-2 核酸檢測(cè)質(zhì)量評(píng)價(jià)體系。核酸擴(kuò)增檢測(cè)中的質(zhì)量屬性包括但不限于:適當(dāng)提取程序性能評(píng)估、評(píng)估檢測(cè)試劑是否滿足最低檢測(cè)標(biāo)準(zhǔn)、分析特異性的綜合評(píng)估、試驗(yàn)的檢出限以及試劑穩(wěn)定性評(píng)價(jià)。質(zhì)量屬性評(píng)價(jià)技術(shù)流程如圖1 所示,包括對(duì)整個(gè)過(guò)程和關(guān)鍵分析性能的評(píng)價(jià)。對(duì)于只使用一種核酸提取方法的核酸擴(kuò)增試驗(yàn),或者提取方法是工作流程的一個(gè)必要組成部分時(shí),核酸提取部分的質(zhì)量評(píng)價(jià)并非是必需的。
1.5 擴(kuò)增技術(shù)的選擇
ISO/TS 5798:2022 指出應(yīng)根據(jù)檢測(cè)要求和環(huán)境,結(jié)合每種擴(kuò)增技術(shù)的特點(diǎn)選擇適合的核酸擴(kuò)增技術(shù)。在適用條件下,逆轉(zhuǎn)錄后,每種擴(kuò)增技術(shù)特點(diǎn)如下。
1.5.1 實(shí)時(shí)定量PCR(qPCR)
適用于樣本定性或定量檢測(cè)。建議使用熒光定量PCR 儀器,并提供穩(wěn)定的電流供應(yīng)。qPCR具有高分析靈敏度和高通量,操作簡(jiǎn)單,但反應(yīng)時(shí)間相對(duì)較長(zhǎng)。
1.5.2 dPCR
適用于樣本絕對(duì)定量檢測(cè),由于樣本需求量低,故其也適用于珍貴或降解嚴(yán)重的核酸樣本。通常建議專門提供一臺(tái)分析和讀取樣本的dPCR 儀,具有反應(yīng)芯片或液滴發(fā)生器并提供穩(wěn)定電流。盡管檢出限低,但其檢測(cè)通量取決于儀器系統(tǒng),另外操作更加復(fù)雜,反應(yīng)時(shí)間也相對(duì)較長(zhǎng)。
1.5.3 等溫?cái)U(kuò)增法
適用于樣本定性評(píng)價(jià),熱循環(huán)器和穩(wěn)定電流供應(yīng)并不是必需的,該方法的特點(diǎn)是低檢出限、低通量、反應(yīng)時(shí)間短,易于操作。
2、 與國(guó)家標(biāo)準(zhǔn)比對(duì)
在ISO/TS 5798:2022 發(fā)布前,國(guó)家市場(chǎng)監(jiān)督管理總局和國(guó)家標(biāo)準(zhǔn)化管理委員會(huì)在2021 年11 月26 日就聯(lián)合發(fā)布了GB/T40982—2021《新型冠狀病毒核酸檢測(cè)試劑盒質(zhì)量評(píng)價(jià)要求》,并于2022 年3 月1 日起實(shí)施。兩個(gè)標(biāo)準(zhǔn)的比較結(jié)果詳見(jiàn)表1。

ISO/TS 5798:2022 是由我國(guó)牽頭,聯(lián)合多國(guó)專家共同制定的,我國(guó)專家團(tuán)隊(duì)全程深度參與,發(fā)揮了關(guān)鍵作用,因此ISO/TS5798:2022 與 GB/T 40982—2021 本質(zhì)和原則是一致的,都為病毒檢測(cè)提供了質(zhì)量評(píng)價(jià)要求和標(biāo)準(zhǔn)化手段。區(qū)別在于,ISO/TS 5798:2022 是在全球各國(guó)SARS-CoV-2 檢測(cè)試劑和實(shí)驗(yàn)分析流程缺乏統(tǒng)一的技術(shù)規(guī)范和質(zhì)量要求的大背景下提出,旨在國(guó)際范圍內(nèi)建立統(tǒng)一的SARSCoV-2 核酸檢測(cè)標(biāo)準(zhǔn),規(guī)范各國(guó)檢測(cè)方法和流程,以保障檢測(cè)質(zhì)量,從而有效控制疫情蔓延,考慮到許多發(fā)展中國(guó)家體外診斷試劑還處于起步發(fā)展階段, 因此ISO/TS 5798:2022 內(nèi)容更加全面,規(guī)定更加細(xì)致,從術(shù)語(yǔ)定義到具體的檢測(cè)程序、設(shè)計(jì)開(kāi)發(fā)、驗(yàn)證確認(rèn)、生產(chǎn)轉(zhuǎn)化和實(shí)施使用都做了詳盡說(shuō)明。而GB/T40982—2021 主要從質(zhì)量評(píng)價(jià)和實(shí)驗(yàn)方法方面提出要求,規(guī)范清晰明了,同時(shí)在附錄部分詳細(xì)注明SARS-CoV-2 核酸檢測(cè)試劑國(guó)家參考品的具體用途、規(guī)格和組成、特性量值和注意事項(xiàng),為國(guó)內(nèi)體外診斷試劑開(kāi)發(fā)人員和制造商及研究機(jī)構(gòu)、醫(yī)學(xué)實(shí)驗(yàn)室提供產(chǎn)品質(zhì)量要求的基本遵循和可參考的技術(shù)依據(jù),實(shí)操性更強(qiáng)。
3、 結(jié)語(yǔ)
疫情發(fā)生以來(lái),我國(guó)一直著力提升核酸檢測(cè)這項(xiàng)核心能力,3年來(lái),我國(guó)核酸檢測(cè)技術(shù)取得飛速進(jìn)步,核酸檢測(cè)能力全球領(lǐng)先。截至2022 年12 月, 國(guó)家藥監(jiān)局已批準(zhǔn)128 個(gè)SARS-CoV-2檢測(cè)試劑盒(45 個(gè)核酸檢測(cè)試劑、41 個(gè)抗體檢測(cè)試劑、42 個(gè)抗原檢測(cè)試劑) 上市[7]。隨著我國(guó)SARS-CoV-2 檢測(cè)技術(shù)不斷取得突破,產(chǎn)品質(zhì)量不斷提升,已成為全球最大的SARS-CoV-2檢測(cè)試劑盒生產(chǎn)國(guó),面向全球銷售,國(guó)內(nèi)多家體外診斷產(chǎn)品生產(chǎn)企業(yè)的SARS-CoV-2 核酸檢測(cè)試劑被列入WHO 應(yīng)急使用清單,以可靠?jī)?yōu)質(zhì)的產(chǎn)品助力全球抗疫。此次ISO/TS 5798:2022 由我國(guó)牽頭制定,從立項(xiàng)到發(fā)布僅用16個(gè)月,是國(guó)際標(biāo)準(zhǔn)化組織醫(yī)用臨床檢驗(yàn)實(shí)驗(yàn)室和體外診斷系統(tǒng)標(biāo)準(zhǔn)化技術(shù)委員會(huì)(ISO/TC212)成立以來(lái)用時(shí)最短的非快速程序制定發(fā)布的標(biāo)準(zhǔn),并最終以96%的贊成率高票通過(guò),充分體現(xiàn)了我國(guó)體外診斷領(lǐng)域的技術(shù)創(chuàng)新水平。此外,參與國(guó)際標(biāo)準(zhǔn)制定還提升了我國(guó)在該領(lǐng)域的話語(yǔ)權(quán)和影響力,更加有利于國(guó)內(nèi)體外診斷行業(yè)和企業(yè)的發(fā)展。
鑒于COVID-19 大流行的現(xiàn)狀和不可預(yù)測(cè)的動(dòng)態(tài),仍需抑制SARS-CoV-2 傳播。在檢測(cè)方法和試劑盒的開(kāi)發(fā)及日常應(yīng)用過(guò)程中,應(yīng)嚴(yán)格遵循國(guó)際標(biāo)準(zhǔn)和國(guó)家標(biāo)準(zhǔn)各項(xiàng)質(zhì)量評(píng)價(jià)指標(biāo),確保檢測(cè)結(jié)果的準(zhǔn)確性。遵循國(guó)際標(biāo)準(zhǔn),與全球SARS-CoV-2 核酸檢測(cè)質(zhì)量評(píng)價(jià)標(biāo)準(zhǔn)相一致,可促成SARS-CoV-2 核酸檢測(cè)技術(shù)的兼容性和互通性,有助于我國(guó)核酸檢測(cè)試劑的出口。