阿爾茨海默癥(Alzheimer’s disease, AD)是由德國精神病和神經病理學家Alois Alzheimer在1906年首次報道,故此病用他的姓阿爾茨海默命名。阿爾茨海默癥屬于神經退行性疾病,多發生于 60 歲以上但也見于中年人群。此病早期癥狀是對近期事物記憶的衰退,接著出現煩躁、易怒、情緒改變、語言障礙,直至喪失記憶、認知功能和日常活動功能,最后導致死亡。根據《The China Alzheimer Report 2022》報告,目前我國的癡呆患者約有1507萬,包括983萬老年癡呆患者,392萬血管性癡呆以及132萬其他類型的癡呆。隨著我國老齡化的進程加快,阿爾茨海默癥的患者也在逐年增加。
過去20多年FDA僅批準了5款AD治療藥物,包括:他克林(Tacrine)、多奈哌齊(Donepezil)、卡巴拉汀(Revastigmine,又名利斯的明)、加蘭他敏(Galantamine)和美金剛(Menantine),其中前四種為乙酰膽堿酶(AchE)抑制劑、美金剛為N-甲基-D-天冬氨酸受體拮抗劑。兩者拮抗劑藥物均為對癥治療,主要是改善認知和記憶障礙,并不能阻止或者延緩病情的進展。2021年6月7日FDA批準了Aducanumab(Aβ 蛋白單克隆抗體)的上市,這是繼2003年之后FDA唯一批準的AD治療藥物。但是該品種有爭議,此處不討論。2019年11月2日,我國國家藥品監督管理局有條件批準了甘露特鈉膠囊(商品名“九期一”)上市注冊申請,用于治療輕度至中度阿爾茨海默病,改善患者認知功能。該品種也有爭議,此處也不討論。
本文主要對阿爾茨海默癥一線用藥鹽酸多奈哌齊進行探討。該藥最早由Eisia(日本衛材)于1983年開始開發。其劑型和規格較多,主要有片劑(3mg、5mg、10mg)、口腔崩解片(3mg、5mg、10mg)、顆粒劑、干糖漿等劑型。2022年FDA批準多奈哌齊透皮貼劑,規格為5mg/天和10mg/天,一周貼一次。其用藥次數減少,針對于阿爾茨海默癥患者來說,極大的改善了用藥順應性。
藥學研究
一、原研情況(摘自原研說明書)
透皮貼劑為一般三層或五層貼劑,而多奈哌齊貼劑具有六層。根據多奈哌齊貼劑說明書顯示如圖。
第一層為包裝背襯/粘合層,第二層為隔離層,第三層為藥物層,第四層為微孔控釋膜,第五層為皮膚粘合層,第六層為背襯層(用時撕開棄用)。
處方:多奈哌齊5mg/天和多奈哌齊10mg/天,兩個規格分別含有88.4 mg或176.7 mg的多奈哌齊,分別以多奈哌齊(15%至35%)和鹽酸多奈哌齊(65%至85%)的形式存在。非活性成分包括丙烯酸酯共聚物、抗壞血酸棕櫚酸酯、交聯聚維酮、甘油、月桂醇乳酸酯、聚丙烯膜、碳酸氫鈉、失水山梨醇月桂酸酯和檸檬酸三乙酯。
用法:貼在背部(避開脊椎)。臨床審查資料中說明,貼在大腿外側,生物利用度偏低,貼在臀部,生物利用度偏高。
儲存條件:2-8℃儲存。
二、如何仿制?
1)原研處方分析
2)藥學研發要求
具體詳見CDE于2020年12月25日發布的《化學仿制藥透皮貼劑藥學研究技術指導原則(試行)》。
目標產品質量屬性(QTPP)是透皮制劑技術開發的一個基本要素,構成了產品研發的設計基礎。對于多奈哌齊貼劑項目,產品主要的QTPP屬性分析如下表所示:
臨床研究
一、原研情況
該品種在FDA 以505b2上市,屬于改良型新藥,臨床方面做的工作為臨床1期+BE,詳細清單如下。
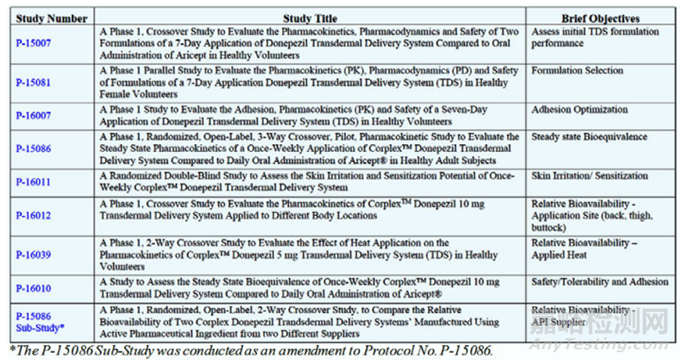
二、如何仿制?
5年內國內已經批準透皮貼劑品種的臨床情況:
注:通過定制檢索軟件進行搜索,排除補充申請品種。
這個結果可能讓很多人失望了,真正的透皮貼劑在國內自主研發獲批的確實沒有,申報的廠家很多,大多是觀望狀態,根據CDE臨床登記平臺數據反應,諸多的廠家都是在觀望能不能做個BE獲批。北京泰德的氟比洛芬貼膏是補充申請,做的大臨床,湖南九典的酮洛芬貼膏也是做的大臨床。這是為什么呢?
眾所周知,Q1、Q2、Q3相同才有可能免臨床;那么,而如何證明Q1、Q2與參比制劑一致,不僅是難度極高的貼膏、貼片,對處方相對簡單的外用軟膏、凝膠、乳膏等也都是難題。所以不能證明藥學一致的情況下,唯有大臨床才可以證明其對原研的一致性。
結論:大概率需要做大臨床
集采過后,立項愈發的艱難,或許透皮制劑是一個選擇,尤其是這種真真正正的對患者帶來好處的品種。只是國內的設備和輔料供應商,還有配套的政策需要一定的時間去跟進。總之,應該會變好的吧。









