生殖發育毒性對生物藥來講,并不是必需要開展的。可以從作用靶點介導的生物學作用、藥代動力學、基因修飾動物數據、人體突變等角度進行權重分析(weight of evidence, WOE)。當然,針對抗腫瘤藥物非臨床評價的ICH S9里面也有提到,對于靶向快速分裂細胞或明確具備發育毒性風險的腫瘤藥物,可以不開展妊娠動物發育毒性研究。建議進行充分的調研和評估,比如人體基因表達情況、藥物能否通過胎盤轉運、靶向相同信號通路藥物對妊娠動物影響、基因修飾動物發育情況等。如果有充分的證據可以識別風險,則不需要額外開展妊娠動物的發育毒性研究。ICH S6中也有類似邏輯的描述。這一策略主要適用于生物藥物。今天主要聊一聊如何對生物藥物是否開展發育毒性研究進行WOE分析。
WOE的目的主要是通過所有可獲得的數據和資料提示人體風險,并基于3R原則盡可能少用或不用動物開展發育毒性研究。WOE考量的要點主要包括:1)藥物的系統暴露及能否穿過胎盤屏障;2)靶點的生物學作用;3)同類別藥物的作用;4)是否具備藥理學相關試驗系統;5)基因修飾動物及人體基因表達情況;6)替代分子。
1、是否有系統暴露及能否穿過胎盤
藥物能否引發胚胎-胎仔發育的異常,很重要的一個考量因素是藥物在外周血的暴露以及能否穿過胎盤屏障到達胎兒所在部位。這點可以通過母體血清藥物濃度檢測實現,并可以通過母體血藥濃度換算胎兒的血藥濃度。如果母體血藥濃度本身就很低,那直接引發發育毒性的風險也就很低。血藥濃度高低的判斷可以結合藥物體外生物學活性數據判斷。如果藥物有母體暴露,但無胚胎-胎仔暴露,還要關注發育毒性嗎?答案是肯定的,需要結合產品的藥理學和毒理學特點進一步評估。
胎盤轉運主要通過三種方式實現:被動擴散(小于1KDa)、易化擴散和主動轉運。多肽和蛋白藥物因分子量和電荷原因,胎盤轉運受限。FcRn作為新生兒受體,主要在胎盤內皮細胞和滋養層細胞表達,可以從母體向胎盤轉運IgG和白蛋白。故IgG亞型的抗體、IgG亞型的融合蛋白、白蛋白修飾的生物藥物等是可以通過FcRn實現胎仔發育階段的局部藥物暴露的(胚胎時期,FcRn轉運貢獻的很少)。所以,這類藥物對母體產生的毒性,對胎兒存在同樣的風險。比如CD20抗體可以引起母體可逆性的淋巴耗竭,預示著胎兒中也會發生類似毒性表現。不過,也要注意甄別種屬間差異,FcRn介導的轉運在人和非人靈長類中主要在妊娠中晚期發生,在嚙齒類動物中則是在整個器官形成時期均發生。所以,抗體在嚙齒類動物中產生的發育毒性數據可能會被高估。除了FcRn路徑以外,還有些其它擴散形式或微囊泡轉運,轉運效率雖然比較低,但對于高活性的分子還是要予以關注。
2、靶點生物學作用
每個靶點都有其介導的生物學作用,可以主要關注靶點在胚胎-胎仔發育、胎盤調節/發育、母體耐受、子宮生理等方面的作用。胚胎-胎仔發育方面,建議重點關注對生長因子、激素、細胞凋亡、血管形成、組織重塑和細胞增殖的影響。比如hedgehog信號通路是與胚胎細胞發育有關的,阻斷該通路可以導致嚴重的胚胎發育異常。如果作用于此通路的藥物可以穿過胎盤屏障,并達到足夠暴露,則可預見引發的發育毒性風險。
許多已上市或在研的生物藥物具有免疫調節作用,或直接影響細胞因子相關通路。比如Ⅰ型干擾素在猴子中可觀察到改變月經周期,誘發自然流產,提示生殖毒性風險。又如免疫檢查點抑制劑則可能會影響母體對胎兒抗原的免疫耐受,從而導致著床后的胎兒流產率增加。
3、同類別藥物的作用
WOE分析也要考慮作用于同樣信號通路的其它同類藥物的數據。這點在ICH S6里面也有注釋,對于已經有大量公開信息提示潛在的生育力和/或發育毒性風險的產品,如干擾素,且這類產品的相關動物種屬只有非人靈長類,則可以從作用機制的角度出發,發揮同樣藥理作用的分子,比如其它新型的改造的干擾素可能具備類似的風險。又如infliximab、adalimumab、golimumab、certolizumab等均是TNF拮抗劑,如果一個分子出現了靶點相關生殖毒性風險,其它分子也要引起注意。
4、是否有合適的藥理學研究相關試驗系統
相關種屬的概念對于從事藥理毒理研究的人群來講已經非常熟悉。開展生殖毒性評估也要解決相關動物種屬的問題。從生殖系統生理學角度評估,非人靈長類與人體是最為接近的。也有研究披露,生物藥物在非人靈長類鑒定出的生殖毒性,在嚙齒類動物中未觀察到。但非人靈長類背景數據少、生育率低、自然流產率高等特點很大程度上限制了其使用。
5、基因改造的動物和人體基因表達
基因編輯技術的進步為生殖毒性研究提供了很多可能。基因敲除小鼠可以模擬靶點完全被抑制的場景,轉基因小鼠則可以用于研究靶點過表達后的生物學作用。通過考察這類小鼠妊娠和胚胎-胎仔發育的異常,對于判斷一個靶點是否具備潛在的生殖毒性具有重要參考價值。比如RANK和RANKL雙敲除小鼠觀察到骨發育異常,提示這一通路與骨的發育相關。如果母體或胎兒暴露在RANK/RANKL拮抗劑的環境下,則有可能出現骨發育異常的情況。事實上,這一擔心在非人靈長類生殖毒性研究中得以確證,說明了基因敲除動物數據的重要價值。當然,還要考慮基因編輯動物獲得的數據可轉化性,比如可能的對其他基因的影響、表型的不穩定等。而且,基因敲除和藥物能否在靶部位實現有效暴露是兩個概念,前者對靶點的調節比較徹底,有可能高估可能的生殖毒性風險。
6、替代分子
這點也很容易理解,與相關種屬選擇的邏輯類似。如果沒有合適的相關種屬用于毒理研究,則可以考慮采用替代分子,比如靶向小鼠靶點的分子。但對替代分子需要做詳細的表征,證明與臨床擬用產品的相似性,比如親和力、功能、下游信號通路、藥效學、脫靶結合、工藝、雜質等。相似度高的替代分子獲得的生殖毒性研究數據對于WOE評估是有價值的。
7、是否需要開展生殖毒性研究的WOE決策樹
上圖代表了WOE評估是否需要開展生殖毒性研究的決策過程。第一步當然是先收集信息,包括靶點的生物學作用、基因修飾動物的數據、人基因表達情況、替代分子數據、作用于同信號通路的同類藥物數據等。此外,可能的胚胎-胎仔部位的暴露量也需要納入考量范圍。畢竟藥物暴露是發揮直接殺傷作用的前提,如果胚胎-胎仔部位暴露量很低,再轉而考慮藥物對母體的藥理作用是否依然會存在風險,比如前文提及的免疫檢查點的免疫調節作用。但如果藥物在母體的系統暴露量也很低,比如局部外用藥或眼部給藥的藥物,對胎兒和母體的影響均有限,則無需進一步開展額外的發育毒性試驗。
脫靶風險也需要考慮,評估依據與擬作用靶點類似,確定脫靶結合的靶點的生物學作用。如果該靶點提示有生殖毒性擔憂,則需要開展進一步研究。如果是作用于外源性靶點的藥物(如細菌靶點),且無內源性結合,則無需額外開展發育毒性試驗。
患者目標人群自然也是考量因素之一。如果藥物的目標適應癥不包括育齡婦女,比如只針對男性的藥物、絕經期后的婦女等,開展發育毒性試驗并不能對人體風險提供有價值信息,無需開展發育毒性研究。但如果藥物是first-in-class產品,且不是針對嚴重威脅生命的疾病,用藥人群包括育齡期女性,基于WOE不能確定風險的情況下,則建議開展發育毒性研究。然后,如果藥物是針對威脅生命的疾病,比如癌癥,且WOE分析明確提示藥物會或不會引發發育毒性,額外的動物試驗并不能提供有價值的信息。
總之,核心要看收集到的各種信息能否對藥物的潛在發育毒性風險做出充分判定,如果能得出是或否的結論,則無需開展額外的動物試驗研究。反之,如果不能,則建議開展進一步發育毒性試驗。按照ICH S6(R1),如果要開展進一步動物發育毒性研究,大鼠或兔是首選,當無其他選擇時,再考慮猴。當然,WOE這一過程并不容易,建議就收集到的信息整理妥當后,尤其是出現要豁免動物試驗的情況時,提前與監管機構進行溝通。
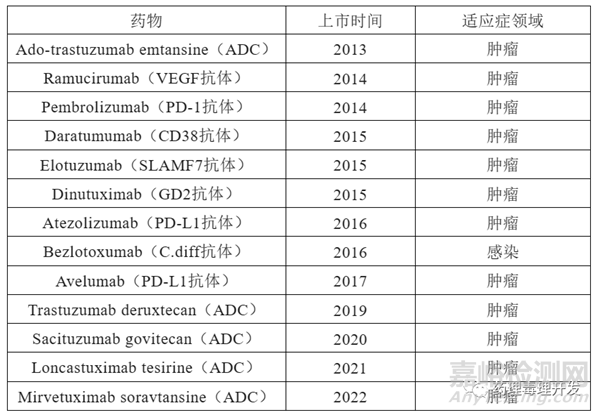
如下表所示,已經有不少已上市生物制品通過WOE分析,未開展動物發育毒性研究。大部分是針對腫瘤適應癥的產品,而且已經明確這類藥物具備胚胎-胎仔相關的發育毒性。唯一一個抗感染的藥物則滿足作用于外源性靶點,與內源性靶點無脫靶結合,所以也需要開展額外發育毒性研究。
以日本第一三共的ADC產品DS-8201為例,關于未開展生殖毒性的原因闡述如下:1)該產品屬于腫瘤藥物,適用于ICH S9,對于靶向快速分裂細胞的藥物或對屬于確定可引起發育毒性的藥物類別,生殖毒性試驗并不是上市必需的;2)大鼠和食蟹猴一般毒理試驗中,可觀察到ADC及毒素分子對快速分類細胞如淋巴細胞、造血器官、睪丸、小腸等有毒性作用;3)毒素分子遺傳毒性中體外染色體畸變試驗、體內微核試驗結果均是陽性;4)單抗trastuzumab對胎兒也有毒性作用。基于以上WOE分析,DS-8201的生殖毒性風險比較確定,故未開展額外的試驗研究。FDA對第一三共的解釋是接受的。