您當前的位置:檢測資訊 > 生產品管
嘉峪檢測網 2024-12-09 15:33
目的 探討污染控制策略在無菌藥品參數放行中的應用。
方法 通過對國內外參數放行相關法規和實踐的總結分析,以及對污染控制策略實施要點的整理歸納,總結污染控制策略在參數放行中的應用方法。
結果 通過對污染控制策略的充分應用,建立了全面的無菌藥品參數放行的微生物污染控制體系,確保生產過程微生物污染控制有效。
結論 運用污染控制策略搭建參數放行的微生物污染防控體系,管控過程要素,能夠確保產品質量,最終實現參數放行。
產品放行是質量保證的重要環節之一,中國、歐盟和美國均規定了對無菌產品的放行要求,其異同點比較如下。
與中國對無菌產品放行前必須進行無菌檢驗的要求不同,歐盟和美國在三十年前已經允許對最終滅菌產品實行參數放行。歐盟和美國對參數放行有不同的定義,在歐盟《藥品生產質量管理規范》(GMP)附錄 17“實時放行檢測和參數放行”中,參數放行是實時放行檢測的一種,是指最終滅菌產品基于對產品生產過程關鍵工藝控制參數的審核進行批次放行而不需要進行最終產品無菌性檢驗 [1]。在美國藥典通則< 1222 >“參數放行”中則將參數放行定義為:不做藥典通則第< 71 >章規定的無菌檢查,根據滅菌關鍵參數標準判定最終滅菌產品無菌合格與否的程序 [2]。而美國注射劑協會第 30 號技術報告(PDATR30)“采用濕熱滅菌法的最終滅菌藥品及醫療器械的參數放行”中,參數放行是指基于對無菌產品經驗證生產工藝的有效控制、監測及文件而建立的無菌放行程序。此程序根據關鍵運行參數及性能屬性決定無菌放行,替代基于最終成品無菌檢查結果的無菌放行 [3]。
雖然歐盟和美國對參數放行的定義描述不盡相同,但從以上定義不難看出,參數放行的核心是以生產過程控制參數的評估、監測和控制為基礎,基于對制造過程中所采集的信息(例如滅菌前中間產品微生物負荷、環境監測數據、相關滅菌參數等),以及與參數放行相關的特定 GMP 要求符合性的審核,更全面、更準確地進行產品無菌保證能力的評價。參數放行體現了藥品質量控制以生產過程控制為重心的基本思想,將對無菌藥品的質量控制從之前的“事后檢測”轉為“事前設計”和“事中制”[4]。因此,對現有的產品或生產工藝實施參數放行,風險管理是必要條件之一,其目的是使每批次產品無菌失敗風險的所有因素得到控制。
1、參數放行的微生物污染控制要求
USP 通則< 1222 >“最終滅菌藥品的參數放行”中要求 [2],參數放行應建立滅菌工藝的微生物監控計劃,以保證產品在最終滅菌前微生物負荷對滅菌工藝驗證確立的微生物控制標準無明顯的偏離。微生物監控計劃需包括對產品、容器、密封件或包裝材料以及生產環境的微生物負荷的監控和評價,監控頻率應根據各種可能的污染源所致的污染情況進行確定。在確定最終滅菌產品參數放行時,應考慮微生物的數量、種類及其對所采用滅菌方式的耐受性。
根據歐盟 GMP 附錄 17“實時放行檢測和參數放行”的要求 [1],參數放行應建立無菌保證計劃,至少包括關鍵工藝參數的識別和監控、滅菌周期的開發和驗證、容器 / 包裝完整性驗證、微生物負荷控制、環境監測計劃、產品隔離計劃、設備、服務和設施的設計及確認計劃、維護和校準計劃、變更控制計劃、人員培訓以及質量風險管理方法。
中國醫藥質量管理協會發布的團體標準“濕熱滅菌無菌產品參數放行要求”中也要求,企業應建立以質量風險管理為基礎的無菌保證系統 [5]。無菌保證系統應至少包括產品設計、物料的微生物控制、工藝控制、對已滅菌和未滅菌產品的隔離措施、產品在有效期內的包裝容器密封性、滅菌器的校準和維護、滅菌工藝開發及其驗證、涵蓋無菌保證系統的質量管理系統等方面。
綜上可知,不論是美國、歐盟還是中國,都從產品工藝的設計和驗證、原輔包 / 藥液 / 中間產品的微生物監控、生產環境的微生物污染監控、生產過程控制等方面,對參數放行的微生物污染監測和控制提出了系統的要求(見表 1)。
表 1 無菌產品的放行要求對比

2、污染控制策略(CCS)的文件框架及實施步驟
CCS 基于對現有產品和工藝的理解,為確保工藝性能和產品質量,針對微生物、細菌內毒素 / 熱原和顆粒物提出的一系列有計劃的控制措施 [6],可包括原料藥、輔料和制劑的物料和組分相關的參數和屬性,廠房設施設備的操作條件,中間過程控制,成品質量標準以及相關方法和監控頻次。如果現有的控制系統得到適當的管理,這些系統可能不需要更換,但應在 CCS 中引用,并且應了解系統之間的相互作用。CCS 的核心是界定系統及流程的所有關鍵控制點,以及系統之間的相互作用,將對設施設備和生產工藝的風險控制措施、針對偏差和工藝過程中數據趨勢分析結果采取的糾正預防措施等進行有效的整合,并將所有關鍵控制點和控制措施的有效性進行關聯評估。
根據歐盟 GMP 附錄 1“無菌藥品生產”的規定及歐洲合規學會(ECA)發布的 CCS 編寫指南 [7],CCS 文件框架需包含的主要要素見表 2。
表 2 CCS 文件框架要素

根據 PDA 第 90 號技術報告《藥品生產中的污染控制策略開發》[8],CCS 文件應包括污染物的潛在進入點和擴散點、污染物的去除和減少能力、污染事件歷史、微生物和病毒屬性、無菌處理、工藝和設備設計以及清潔、消毒和滅菌原則的技術知識總結,還應考慮原材料質量和質量風險管理原則。這些要素對于防止生產過程的每個步驟中的污染至關重要,其要素包括:
① 工藝設計、微生物控制和監測:需考慮生產過程控制和過程監控。
② 設施和公用設施:需考慮設施的設計,人流、物料和廢棄物的控制,設施的清潔和消毒,公用設施設計,控制和驗證,工藝用水和蒸汽,暖通空調(HVAC),工藝氣體等。
③ 原材料:需考慮質量標準、微生物負荷來源、取樣、供應商審計等。
④ 環境控制、驗證和監測:需考慮環境性能確認、環境和公用設施中斷和恢復計劃。
⑤ 人員培訓和資質:需考慮個人衛生、更衣及潔凈室行為等。
⑥ 設備設計、驗證和持續控制:需考慮設備的設計、清潔驗證、持續控制及維護等。
⑦ 產品容器密封系統:需考慮內包裝的組成及控制、全生命周期內容器密閉系統的完整性。
⑧ 質量體系:包括趨勢和量度、調查、糾正和預防措施、變更控制、質量風險管理、質量協議和供應商管理、質量控制等。
⑨ CCS 管理和有效性審查:CCS 的管理主要分為 CCS 的開發、CCS 文件編制、CCS 評估三個階段,具體實施步驟包括收集現狀、開展現狀與法規的差距分析、實施風險評估、記錄所有控制措施并編制 CCS 文件、評估措施的有效性并持續更新,即在充分理解產品和工藝知識、當前控制措施的基礎上,詳細收集現場的現狀信息,以歐盟 GMP 附錄 1 的要求為標準,分析現狀與法規要求之間的差距,全面評估生產過程中可能的污染源,針對識別的污染源開展風險識別,并輸出和實施控制措施進行改善,最后將識別的風險和全面的控制措施整理編制成 CCS 文件并定期回顧更新。
3、CCS 在參數放行中的應用
相比檢驗放行的產品,參數放行產品對微生物污染監控的要求更高,但微生物的影響因素多,來源復雜且具有不確定性,因此,運用風險管理工具,分析生產過程的每個工藝步驟和無菌保證程序的每個要素,進行全系統、全流程的微生物 / 無菌關鍵風險點識別和控制是至關重要的 [9]。在實施參數放行前及實施過程中,均應基于對具體工藝和產品信息的深入了解,明確需要控制的微生物污染類型,定義微生物污染控制的范圍及措施。系統性、結構化的評估工具的運用有助于對參數放行無菌保證計劃中的所有風險因素進行系統的識別、評估、控制和回顧。作為一個用于建立綜合的污染預防策略的系統性工具,CCS 文件總結了影響微生物污染控制水平的每一個要素,并維持適當的微生物污染水平。下面就以微生物污染風險的控制為例,從兩個方面探討如何運用 CCS 工具進行最終滅菌注射劑參數放行的全面微生物污染控制。
3.1 CCS 文件框架指導構建參數放行整體微生物控制策略
參數放行的無菌保證主要涉及四個環節:微生物的來源控制、微生物的去除、微生物的殺滅、容器系統密封性保證。為了達到對微生物污染進行系統控制的目的,本文從影響無菌保證水平的四個環節出發,參考 ECA 發布的 CCS 文件框架中的各個 CCS 要素,建立系統化的 CCS 要素與無菌保證評估矩陣,詳見表 3。
表 3 CCS 要素與無菌保證評估矩陣
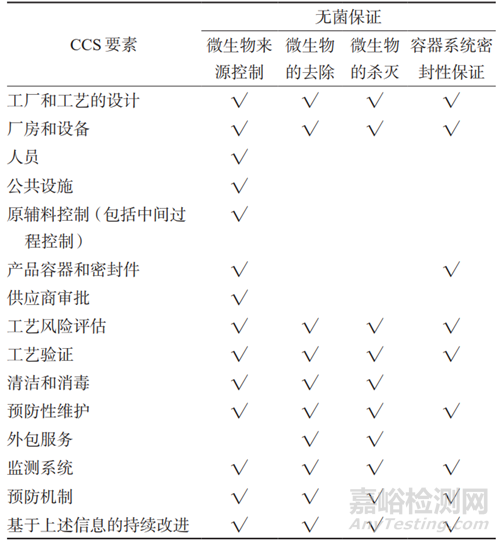
根據以上分析評估矩陣,建立參數放行微生物CCS,介紹詳見表 4[7]。
表 4 參數放行微生物 CCS

3.2 CCS 工具指導評估和管理參數放行無菌保證關鍵參數
參數放行是以生產過程工藝相關數據審核為基礎的放行系統,因此根據藥品和滅菌工藝的特性評估合適的關鍵參數并制定參數放行標準是至關重要的。根據控制點對無菌保證水平的影響程度,參數放行的參數可分為關鍵控制點(CCP)、重要控制點(KCP)和基礎控制點(BCP)三類。CCP 的評估可參考圖 1 決策樹進行。
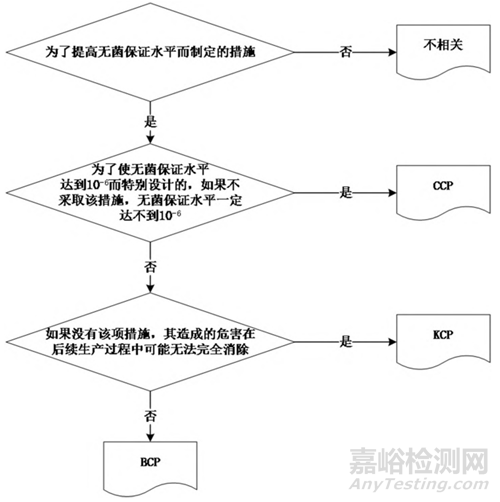
圖 1 關鍵控制點評估決策樹
根據微生物的 CCS 框架,對無菌保證相關的CCS 各要素進行微生物危害識別,包括但不限于工藝設計、微生物控制和監測、人員培訓和資質、廠房設施和公用系統、設備設計驗證和持續控制、物料、環境控制驗證和監測、產品密封性、質量體系等,列出控制措施和控制標準,并對每個控制措施進行決策樹判斷,從而完整地輸出CCP、KCP 和 BCP。表 5 以 CCS 中滅菌工藝設計和微生物控制、監測兩個要素為例,指導 CCP、KCP和 BCP 的評估和管理。
利用 CCS 文件的框架和主要要素構建了參數放行的整體微生物控制策略,并指導評估輸出CCP、KCP 和 BCP,參數放行是 CCS 在微生物污染控制方面的良好實踐。
4、參數放行實踐促進對 CCS 的實施及管理
CCS 能指導參數放行微生物污染控制體系的建立,參數放行的實踐經驗也能進一步促進 CCS 的落地實施。下面從兩個方面闡述參數放行的良好實踐如何促進 CCS 的管理。
將 CCS 策略參數化和標準化,能促進污染控制措施的落地實施和有效監控。生產過程工藝相關參數的識別和控制范圍標準化是參數放行的基礎,通過定期對基于 CCS 要素評估輸出的 CCP、KCP和 BCP 的運行情況進行回顧和趨勢分析,可對各項微生物控制措施的有效性進行科學的評估,并在出現異常趨勢時及時更新控制策略和控制措施,確保污染風險可控。同樣,將 CCS 策略中關于細菌內毒素 / 熱原和微粒污染控制的相關指標參數化,并制定適當的控制標準,通過對過程參數的持續監控和回顧來評價 CCS 策略的有效性,并在出現異常趨勢時對策略和控制措施進行及時更新。
參數放行的大數據和預測模型支持建立 CCS多樣化的分析模型。為了維護潔凈區環境的穩定性,建立潔凈區微生物分布地圖和預警模型是參數放行微生物污染控制的重要措施。通過對日常環境監測、物料、產品等收集的污染菌進行鑒定,了解污染菌的分布情況,系統分析污染菌的來源,并建立動態分布地圖,通過大數據分析建立微生物污染預警,根據預測趨勢針對性地及時采取殺孢子劑或其他特定消毒等防控措施。這種方法不僅適用于對微生物污染的控制,同樣也適用于對細菌內毒素 / 熱原和微粒的預測控制。例如,通過建立燈檢發現的可見異物類型與其可能來源的對應關系,建立動態來源分析圖,通過各微粒來源點的監控情況提前預警可能的異物引入風險,及時消除微粒風險。
5、總結和討論
參數放行在中國的發展相對較晚,自 2005年國家食品藥品監督管理總局批準無錫華瑞和廣州百特兩家企業進行參數放行試點后,目前國內僅有上海通用電氣藥業有最終滅菌注射劑產品以參數放行申報 FDA 獲批。此外,四川科倫藥業于 2018 年在公司內部啟動實施參數放行項目的工作,成立項目組,并于 2020 年在公司內部模擬運行參數放行。在參數放行的法規和標準方面,2020 年中國醫藥質量管理協會發布了團體標準《濕熱滅菌無菌產品參數放行要求》。
CCS 雖然并非是一個全新的要求,但是它要求企業整合已有的污染控制措施,形成一個全面的整體控制方案,連接整個生產體系中的關鍵控制點,以確保所有監控措施的有效性。如何建立和管理CCS,在歐盟、美國 PDA 和 PHSS 有相關的指導原則,但在國內暫無統一的模式和具體的操作要求。
參數放行是新構的體系,與 CCS 互有值得借鑒之處。根據系統化的 CCS 文件框架和主要要素,全面識別和控制參數放行的無菌保證風險,建立系統的微生物 CCS,輸出完整的參數控制點,這是 CCS 在參數放行的良好實踐。而參數放行對過程控制的參數化和標準化,以及利用大數據建立預測模型的管理方式,也為 CCS 有效性的評估和回顧提供了更為具體的操作參考。
參考文獻
[1] European Commission. EU GMP Annex 17:Real Time Release Testing and Parametric Release [EB/OL].(2018-06-26)[2023-08-10]. https://health. ec. europa. eu/system/files/2018-06/2018_annex17_en_0. pdf
[2] USP. < 1222 > Terminally Sterilized Pharmaceutical Products-Parametric Release:GUID-47A43122-C422-4E0BBF92-3B408614555A_6_en-US. [EB/OL]. [2023-08-10].https://online. uspnf. com/uspnf/document/1_GUID47A43122-C422-4E0B-BF92-3B408614555A_6_en-US.
[3] 中國醫藥設備工程協會 . 美國注射劑協會技術報告匯編:1 號、20 號和 48 號[M]. 北京:中國質檢出版社,2019.
[4] 尚悅 . 無菌藥品參數放行國際實施歷程及我國現狀淺析 [J]. 中國醫藥工業雜志,2021,52(9):1248-1252.
[5] 中國醫藥質量管理協會 . 濕熱滅菌無菌產品參數放行要求 [M]. 北京:中國標準出版社,2021.
[6] European Commission. EU GMP Annex 1:Manufacture of Sterile Medicinal Products [EB/OL].(2022-08-22)[2023-08-10].https://health. ec. europa. eu/system/files/2022-08/20220825_gmp-an1_en_0. pdf.
[7] ECA Foundation. How to Develop and Document a Contamination Control Strategy. [EB/OL].(2023-02)[2023-08-10].https://www. eca-foundation. org/files/userFiles/documents/20220119-ECA-Task-Force-CCS-Guideline-Vers2. pdf.
[8] Parenteral Drug Association. PDA Technical Report No. 90(TR 90)Contamination Control Strategy Development in Pharmaceutical Manufacturing [EB/OL].(2022-12)[2023-08-10]. https://techpubportal. pda. org/publication/?i = 782488.
[9] 尚悅,馬仕洪,張啟明,等 . 科學監管方法之濕熱滅菌藥品參數放行探索研究 [J]. 中國藥事,2022,36(5):497-502.
本文作者湯平1,蔣芙蓉1,陳超2,申景豐1,李長林3*,1. 湖南科倫制藥有限公司;2. 湖南省藥品審評與不良反應監測中心;3. 湖南省藥品監督管理局,來源于中南藥學,僅供交流學習。

來源:Internet


