您當前的位置:檢測資訊 > 法規標準
嘉峪檢測網 2020-01-03 10:51
《ISO 14971 醫療器械-風險管理對醫療器械的應用》標準自2016年啟動升版,經過三年的討論和修訂,最終的版本于2019年12月發布。本次修訂是在2000版和2007版的基礎上,進行的第三版的修訂。第三版的修訂,是由ISO/TC 210和IEC/SC 62A技術委員會聯合進行,這是在2016年對ISO 14971標準進行系統的評估的基礎上,以及著眼更嚴格的法規要求而進行的。ISO 14971的姊妹篇ISO/TR 24971也在同步修訂,預計會在2020年發布。
ISO 14971下載地址http://www.towbao.com/data/q-14971.html
十大主要變化
基于ISO 14971:2019前言(Foreword)部分
變化1
按照ISO/IEC指令(Clause 15 of ISO/IEC Directives, Part 2:2018)的架構要求,增加了第二章節引用標準(Normative references),但實際的第三版的ISO 14971:2019并沒有引用任何標準。
變化2
更新了相關定義,并且采用了ISO/IEC Guide 63:2019里面新的定義,并且相關定義在標準中用斜體印刷。比如:
伴隨文件(accompanying documentation)的定義,用Material取代了document,并在注解2指明伴隨文件并不單指書面的或者印刷的文件,還包括聲音、視覺、觸覺和多媒體等形式的文件形式。在注解1中列舉伴隨文件包括說明書(instructions for use)、技術說明(technical description)、安裝手冊(installation manual)、快速使用指南(quick reference guide)等
危害(Harm)定義去掉了物理的(Physical),使得危害的定義比原來更加廣泛。
變化3
新增加三個定義:
受益(Benefit):使用醫療器械對個人健康的正面影響或期望的結果, 或對患者管理或公共健康的正面影響。
備注:受益可以包括對臨床結果的正面影響、病人的生活質量、診斷有關的結果、與診斷器械對臨床結果或公共衛生的正面影響
合理可預見的誤用(reasonably foreseeable misuse):沒有按照制造商的預期使用一個產品或者系統,但這些結果是根據人類行為可以容易預測的。
現有技術水平(state of the art ):根據相關科學、技術和經驗的綜合考慮,在特定時間內對產品、工藝和服務開發所應達到的技術能力水平。備注:現有技術水平體現了當前和普遍接受的技術和醫學的良好實踐。現有技術并不一定意味著是最先進的技術和解決方案。這里描述的現有技術水平有時被稱為“普遍公認的技術水平”。
變化4
更加關注使用醫療設備所帶來的“受益”。“受益-風險分析”與有些法規的術語保持一致(比如歐盟的MDR和IVDR)。
變化5
澄清ISO 14971:2019規定的流程可以用于管理與醫療器械相關的風險,包括數據和系統安全的風險。
變化6
綜合剩余風險的評價方法和接受準則需要在風險管理計劃中確定。該方法可以包括收集和評審該醫療器械、市場上同類器械和同類的其它產品的數據和文獻。對綜合剩余風險的接受準則可不同于單個風險接受的準則。
變化7
在對綜合剩余風險進行評估和判斷可接受后,將單個剩余風險的告知移入到綜合剩余風險的告知的要求(條款8)。
變化8
醫療器械上市前,必須要評審風險管理計劃的執行情況。評審的結果必須在包括在風險管理報告中。
變化9
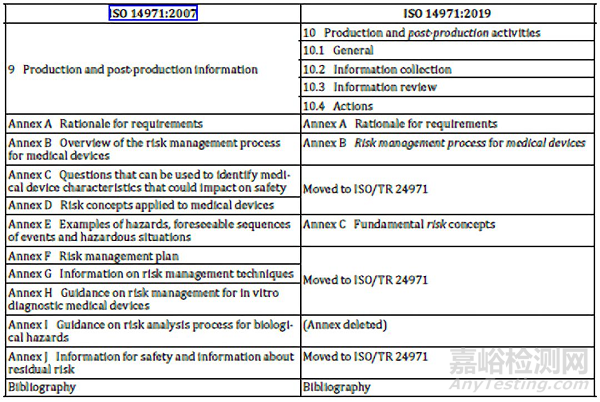
生產和生產后信息的條款進行了澄清和重新調整,對信息的收集和針對安全相關信息所采取的措施的要求進行了細化。
變化10
幾個參考的附錄將轉移動ISO/TR 24971,ISO/TR 24971也在同步修訂。ISO 14971第三版修訂的理由和標準要求的解釋在附錄A里面有描述。附錄B增加了第二版和第三版的條文對照表,見如下:



來源:Internet


