您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2023-08-29 10:05
呼吸系統過濾器通常由殼體和濾芯組成,包含一個進氣口和一個出氣口,可有若干氣體采樣口和密封蓋,一般為無菌供應,一次性使用。該類產品與麻醉和呼吸設備和肺功能儀相配套,供降低患者吸入或呼出顆粒性物質(包括微生物)的數量用。
呼吸系統過濾器在《醫療器械分類目錄》中管理類別為Ⅱ類,分類編碼為08-05-03。
一、呼吸系統過濾器結構組成和工作原理
產品通常由上蓋、過濾介質、下蓋、輔助端口(如有)、護帽(如有)等組成。
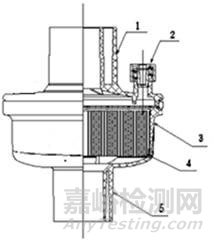
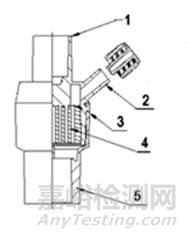
圖1
1-機器端口;2-輔助端口;3-外殼;4-過濾介質;5-患者端口
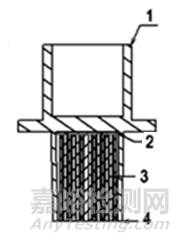
圖2
1-患者端口;2-外殼;3-過濾介質;4 -機器端口
呼吸道中的病原微生物主要以水分為載體,呼吸系統過濾器中的過濾介質(過濾膜)可使用聚丙烯復合材料等制成,疏水性能好且孔徑小,呼吸系統過濾器的機器端口與患者端口的兩端存在壓力差,過濾介質中的濾孔,可對氣體中的微粒(包括微生物)過濾,防止空氣中懸浮的細菌及病毒通過,允許水蒸氣通過,但不允許液態水通過。
呼吸系統過濾器的過濾原理主要為攔截效應、慣性效應、擴散效應、靜電效應。
攔截效應:當較大粒子沿著流線運動到纖維表面,較大粒子被過濾材料機械篩濾作用攔截而沉積下來,原理示意圖如圖3所示;慣性效應:當粒子質量較大或者速度較大,在流線拐彎時,粒子由于慣性作用脫離流線撞擊到濾材表面,因吸附力停留在撞擊表面,原理示意圖如圖4所示;擴散效應:由于氣體分子熱運動對粒子的碰撞而產生的粒子的布朗運動,粒子布朗運動擴散位移到過濾纖維中被吸附,對于越小的粒子越顯著,原理示意圖如圖5所示;靜電吸附效應:粒子被過濾材料的靜電作用吸附而沉積下來,原理示意圖如圖6所示。
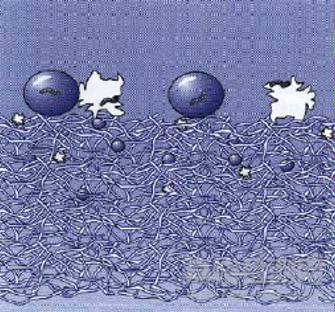
圖3 直接攔截示意圖
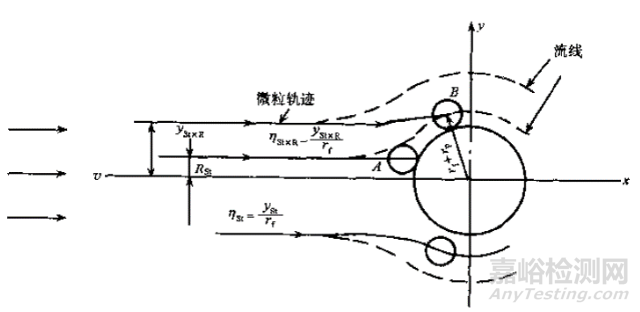
圖4 慣性沖撞示意圖
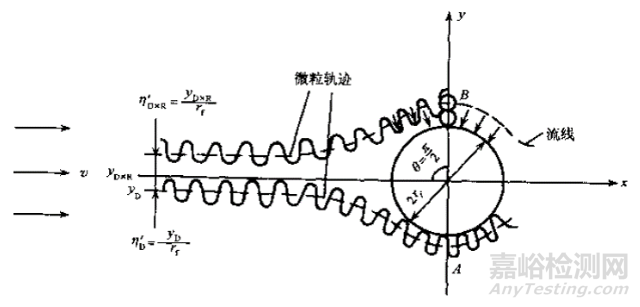
圖5 擴散攔截示意圖
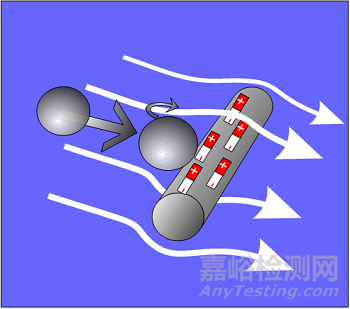
圖6 靜電吸附示意圖
二、呼吸系統過濾器的主要風險
根據GB/T 42062《醫療器械風險管理對醫療器械的應用》附錄C對“呼吸系統過濾器產品”已知或可預見的風險進行判定,產品在進行風險分析時至少應包括以下的主要危害(表1),企業還應根據自身產品特點確定其他危害。
表1 產品主要危害
|
危害的分類 |
危害的形成因素 |
可能的后果 |
|
|---|---|---|---|
|
生物與化學危險 |
生物污染 |
生產環境控制不好。滅菌操作不嚴格。包裝破損。使用時操作不正規。 |
產品帶菌,引起患者使用時感染。 |
|
生物不相容性 |
增塑劑、加工助劑、 環氧乙烷殘留量超標。 |
產生細胞毒性、致敏反應、急性或慢性毒性。 |
|
|
不正確的成分(化學成分) |
未按照工藝要求配料。小分子物質殘留量過大。 |
造成毒性危害。 |
|
|
加工工藝 |
加工工藝控制不嚴格,后處理工藝控制不嚴格。 |
引入有害物質,引起患者感染或造成毒性危害。 |
|
|
再感染和/或交叉感染 |
使用不當、標識不清。 |
引起局部或者交叉感染。 |
|
|
環境因素 |
儲存或運行偏離預定的環境條件 |
儲運條件(如溫度、濕度)不符合要求。 |
產品老化。 無菌有效期縮短。 |
|
意外的機械破壞 |
儲運、使用過程中發生意外的機械性破壞。 |
產品使用性能無法得到保證。 |
|
|
由于廢物和/或醫療器械處置的污染 |
使用后的產品沒有按照要求集中銷毀。 |
造成環境污染或者細菌的交叉感染。 |
|
|
可用性 |
不適當的標記 |
標記不清晰、錯誤、 沒有按照要求進行標記(如無菌或非無菌)。 |
錯誤使用。 儲存錯誤。 產品辨別錯誤。 非預期環境使用非無菌產品引起患者感染。 |
|
不適當的操作說明,如: 與其他器械配合使用不適當;偏離使用說明;說明書關于使用說明不全面 |
包裝破損無法識別。 操作要點不突出,如過濾器放置過低,導致液體流入呼吸系統過濾器。
|
無法保證使用安全性。 液體流入呼吸系統過濾器,導致氣流阻力增加。 |
|
|
由不熟練/未經培訓的人員使用 |
操作不熟練、操作失誤。 |
導致延誤或不正確治療。 |
|
|
合理可預見的誤用 |
規格型號選用錯誤。 |
導致無法達到滿意的效果。 |
|
|
對一次性使用醫療器械很可能再次使用的危險(源)警告不適當 |
造成重復使用。 |
交叉感染。 |
|
|
不宜或應謹慎使用呼吸系統過濾器的情形未充分提示,如飽胃、腸梗阻、上呼吸道敏感、有哮喘病史的患者 |
導致相關并發癥的發生。 |
咳嗽、嘔吐、反流誤吸、喉痙攣等。 |
|
|
功能性 |
對醫療器械壽命終止缺少適當的決定 |
沒有標識產品有效期。 |
超出滅菌有效期/使用期限的產品被使用,造成細菌感染。 |
|
不適當的包裝(醫療器械的污染和/或變質) |
沒有進行包裝確認。 |
不能確保產品無菌,從而導致出現細菌感染。 |
|
|
再次使用和/或不適當的再次使用 |
產品標識沒有明確只限一次性使用。 |
出現細菌感染、交叉感染以及粘膜損傷等現象。 |
|
三、呼吸系統過濾器的性能研究實驗要求
1、產品技術要求
1.1物理性能
1.1.1外觀
應整潔,色澤應均勻,應無傷痕、劃痕、裂紋、飛邊及鋒棱。
1.1.2尺寸
1.1.2.1呼吸系統過濾器機器端口和患者端口應符合相關標準(如YY/T 1040.1);若有輔助端口(如用于氣體采樣、監護和壓力檢測等連接的端口),該端口應不能與符合YY/T 1040.1和YY/T 1040.2中15mm或22mm的圓錐接頭相連接,該端口應提供一個封堵裝置。
1.1.2.2企業應根據實際情況制定尺寸要求。(如適用)
1.1.3壓降
1.1.4氣體泄漏
1.1.5過濾效率(濾除率)
1.1.6順應性
1.1.7細菌過濾性能(如聲稱具有細菌過濾性能),檢驗方法可參考YY 0469附錄B。
1.1.8病毒過濾性能(如聲稱具有病毒過濾性能),檢驗方法可參考YY/T 1497。
1.1.9死腔體積(如適用)
1.2化學性能
1.2.1根據不同材料特性,由企業對化學性能提出要求。
1.2.2用環氧乙烷滅菌的產品應規定環氧乙烷殘留量的要求。
1.3微生物要求
非無菌供應一次性使用的產品,若產品使用前不需要進行消毒、滅菌處理,應對其微生物限度進行評價,同時可參考《中華人民共和國藥典》中微生物限度檢查法進行檢測。
1.4無菌
若以無菌形式提供,產品應無菌。
1.5若產品包含成人與兒童規格,應結合產品功能、結構制定相關性能要求(如不同氣體流量條件下的壓降要求)。
2、產品性能研究
2.1生物相容性研究
應明確呼吸系統過濾器與人體間接接觸部件的材料,以及接觸的性質和時間,參照GB/T 16886系列標準或《醫療器械生物學評價和審查指南》、YY/T 1778.1的要求對其進行生物相容性評價。
2.2滅菌工藝及潔凈控制工藝研究
2.2.1滅菌研究:開展研究明確產品的滅菌工藝(方法和參數)和無菌保證水平(SAL)。可參考GB 18278《醫療保健產品滅菌濕熱》系列標準、GB 18279《醫療保健產品滅菌環氧乙烷》系列標準、GB 18280《醫療保健產品滅菌輻射》系列標準等。若滅菌使用的方法容易出現殘留,如環氧乙烷滅菌,應當開展研究明確殘留物信息及采取的具體處理措施,參考《醫療器械生物學評價第7部分:環氧乙烷滅菌殘留量》(GB/T 16886.7)等,明確殘留物(如環氧乙烷)殘留量接受標準及其確定依據。
如果滅菌方式會導致有害物質殘留,應進行相關評價。如過濾介質等易吸附環氧乙烷,環氧乙烷殘留量超標會產生相應危害。
2.2.2潔凈提供的非無菌呼吸系統過濾器,應明確微生物限度,微生物控制方法、環境及管理要求及檢驗方法可結合產品的危險性程度和臨床使用最不利情況。可參照GB 15982《醫院消毒衛生標準》及《中華人民共和國藥典》開展研究。
3、產品穩定性研究
3.1產品有效期和包裝研究情況可通過實時老化或加速老化試驗獲得。加速老化試驗及產品包裝驗證可參照相關系列標準,如YY/T 0681、YY/T 0698、GB/T 19633等。
3.2開發人應開展包裝研究,依據有關國內、國際標準進行(如GB/T 19633.1等)對包裝進行分析研究和評價。
需要開展運輸穩定性研究,證明在宣稱的有效期內,規定的運輸條件下,運輸過程中的環境條件不會對醫療器械的造成不利影響。
4.加工助劑的研究
對生產加工過程中所使用的所有輔劑、助劑、粘合劑等添加劑均應說明使用劑量,開展對殘留量、可揮發物質總量的控制措施和接受標準以及安全性驗證研究。
5.其他
對于列入《免于臨床評價醫療器械目錄》(以下簡稱《目錄》)的呼吸系統過濾器,應當按照《列入免于臨床評價醫療器械目錄產品對比說明技術指導原則》,證明產品與《目錄》所述的產品具有基本等同性。若無法證明產品與《目錄》所述的產品具有基本等同性,則應開展臨床評價。

來源:嘉峪檢測網


