今日頭條
映恩婦科ADC擬納入突破性品種。映恩生物與BioNTech公司合作開發的HER2 ADC藥物DB-1303(BNT323)獲CDE擬納入突破性治療品種,擬用于治療既往免疫檢查點抑制劑(ICI)治療期間或治療后進展的晚期、復發性或轉移性HER2表達子宮內膜癌。在Ⅰ/Ⅱ期臨床中,DB-1303未經確認的客觀緩解率(ORR)和疾病控制率(DCR)分別為58.8%和94.1%。此前FDA已授予DB-1303針對子宮內膜癌的突破性療法認定和快速通道資格。
國內藥訊
1.葆元/信達肺癌新藥報新NDA。信達生物與葆元醫藥開發的新一代ROS1/NTRK抑制劑己二酸他雷替尼膠囊(DS-6051,泰萊替尼)的第二項上市申請獲CDE受理,用于一線治療未經ROS1 TKI治療的局部晚期或轉移性ROS1陽性非小細胞肺癌(NSCLC)。值得一提的是,該藥用于治療經ROS1-TKI治療失敗的ROS1陽性局部晚期或轉移性NSCLC患者的首個NDA正接受CDE優先審評。
2.君實PD-1鼻咽癌Ⅱ期臨床見刊。君實生物PD-1單抗特瑞普利單抗聯合卡培他濱治療殘留鼻咽癌患者的Ⅱ期臨床積極結果已發表于《自然-通訊》期刊上。結果顯示:特瑞普利單抗聯合卡培他濱治療6周期,客觀緩解率(ORR)達到95.7%,疾病控制率(DCR)為100%;12個月及24個月的無進展生存期(PFS)率分別為95.7%和82.4%。此外,特瑞普利單抗聯合用藥耐受性良好。
3. 信達哮喘新藥啟動澳洲臨床。信達生物IL-4Rα/TSLP雙抗IBI3002在澳大利亞啟動首次人體(FIH)I期臨床(NCT06213844),擬評估IBI3002在健康受試者和輕中度哮喘受試者中的安全性、耐受性、藥代動力學(PK)以及治療中重度哮喘的初步療效。BI3002具有高效的IL-4Rα和TSLP共同阻斷功能,有望為包括哮喘在內的炎癥性疾病患者提供新的治療選擇。
4.復星NK細胞療法獲批IND。復星醫藥旗下精繕生物1類新藥“GCK-01細胞注射液”獲國家藥監局臨床許可,擬開發治療復發或難治性濾泡性淋巴瘤(FL)。GCK-01是一款同源異體外周血來源的現貨型NK細胞療法,以CD20為靶點,通過改造NK細胞的功能,使其能夠更高效地識別和攻擊腫瘤細胞。此前,研究者發起了一項臨床試驗,評估GCK-01治療復發或難治性B細胞非霍奇金淋巴瘤患者的效果。
5.成都先導引進降脂新藥獲批IND。成都先導旗下公司成都先衍生物引進的1類化藥A24110He注射液(Lipisense®)臨床試驗申請(IND)獲CDE批準,擬開發用于治療嚴重高甘油三酯血癥。Lipisense®是瑞典Lipigon公司開發的一款靶向ANGPTL4的反義核酸(ASO)藥物,旨在長效降低甘油三酯的同時改善胰島素抵抗,有望為血脂異常或嚴重高甘油三酯血癥患者提供新的治療選擇。先衍生物擁有A24110He的大中華區權益。
6.復宏漢霖2023年扭虧為盈。復宏漢霖發布正面盈利預告,2023年度未經審核的年內利潤不低于5億元,2022年則為虧損6.95億元,這也是復宏漢霖在2023年上半年首次實現半年度盈利之后,首次實現全年度盈利。從此前三季報的數據來看,前三季度總收入39.3億元,產品收入33.8億元,其中漢曲優(曲妥珠單抗)9個月大賣20.14億元,漢斯狀(斯魯利單抗)大賣8.65億元,漢利康(利妥昔單抗)銷售額3.85億元。
國際藥訊
1.Hugel公司醫美肉毒素獲批上市。Hugel America公司A型肉毒素Letybo(letibotulinumtoxinA)獲FDA批準,用于治療成人中度至重度眉間紋。Letybo是一種乙酰膽堿釋放抑制劑和神經肌肉阻滯劑,通過肌肉內注射,可改善與皺眉肌/降眉肌活動相關的中重度眉間紋外觀。在Ⅲ期試驗中,與安慰劑相比,Letybo治療第4周時患者的眉間紋改善獲得0或1分、且在最大皺眉時較基線改善至少2分的受試者比例更高。
2.AZ/第一三共ADC歐盟報新NDA。阿斯利康與第一三共開發的靶向TROP2的ADC藥物Dato-DXd(Datopotamab deruxtecan)的兩項上市許可申請(MAAs)獲歐盟EMA受理,用于治療局部晚期或轉移性非鱗狀非小細胞肺癌(NSCLC)經治患者;以及用于治療不適合內分泌治療的轉移性HR陽性、HER2低表達或陰性(IHC 0、IHC 1+或IHC 2+/ISH-)乳腺癌經治患者。此次申請MAAs是基于關鍵III期TROPION-Lung01研究以及TROPION-Breast01研究的積極數據。
3.SpringWorks公司罕見病新藥報NDA。SpringWorks公司MEK抑制劑mirdametinib已啟動向FDA滾動遞交新藥申請(NDA),用于治療兒童和成人神經纖維瘤病1型相關的叢狀神經纖維瘤(NF1-PN)。在Ⅱb期ReNeu試驗中,經盲態獨立中心(blinded independent central review,BICR)評估,mirdametinib在兒童和成人患者中獲得確認的客觀緩解率分別為52%和41%;靶腫瘤體積分別縮小42%和41%。此前,FDA和歐盟EMA均授予mirdametinib治療NF1的孤兒藥資格。
4.Avidity公司AOCs藥物將上Ⅲ期臨床。Avidity Biosciences公司抗體偶聯寡核苷酸(AOCs)藥物del-desiran(AOC 1001)治療1型強直性肌營養不良(DM1)的擴展研究(MARINA-OLE)結果積極。與自然病史研究人群相比,AOC 1001治療一年期間可在多個臨床終點上逆轉疾病進展,包括肌張力、肌肉力量和患者報告的日常生活活動;且藥物長期耐受性良好,所有相關不良事件(AE)均為輕中度。該公司計劃盡快啟動Ⅲ期臨床HARBOR。
5.Akero公司MASH新藥長期療效積極。Akero公司FGF21類似物efruxifermin (EFX) 治療肝硬化前代謝功能障礙相關脂肪性肝炎(MASH)的IIb期研究結果積極。在第96周時,與安慰劑相比,Efruxifermin(50mg和28mg)治療組達到的緩解的患者比例更高(75%vs24%,p<0.001;46%vs24%,p=0.07);有更多患者達到2級纖維化改善且MASH沒有惡化(36%和31%,vs3%)。目前,該新藥正在III期SYNCHRONY研究中評估用于代償性肝硬化(F4)MASH的治療效果。
6.默克聯手C4T開發新型蛋白降解劑。德國默克與C4 Therapeutics(C4T)公司將利用后者專有TORPEDO技術平臺,針對默克所選的兩個關鍵致癌蛋白,合作開發新型蛋白降解劑。根據協議,C4T將獲得1600萬美元的前期付款,可能高達7.4億美元的藥物發現、監管和商業里程碑后期付款。德國默克將負責合作候選藥物的臨床開發和商業化。
醫藥熱點
1.人大代表建議制定“心血管健康促進法”。3月5日,在全國兩會上,第十四屆全國人大代表、華中科技大學同濟醫學院附屬同濟醫院內科學系名譽主任汪道文教授就加強心血管健康管理提出制定“心血管健康促進法”的建議。他希望通過立法手段,提升心血管疾病的預防和控制能力,推動醫防協同,并將心血管疾病的預防工作納入基層組織的行政管理考核體系,以全面提升國民心血管健康水平。
2.上海擬建設數字健康城區和未來醫院。2024年上海市衛生健康工作會議于2月28日召開,圍繞醫療資源配置,提出了今年一系列建設目標:推進各類國家級試點,優化公立醫院績效考核指標體系;力爭新增1-2家國家醫學中心和一批國家臨床重點專科;建設30家護理中心、15家示范性康復中心和50家開展中醫藥巡診服務的社區衛生服務站點等。此外,推進數字化轉型,促進互聯網醫院發展,建設數字健康城區和未來醫院,開展區塊鏈創新應用試點。
3.韓國:未復崗醫生執照將被吊銷至少3個月。韓國保健福祉部第二次官樸敏守當地時間3月4日上午在記者會上宣布,計劃對醫生集體辭職離崗行動核心負責人采取嚴厲措施。韓國政府將現場檢查醫生的出勤情況,如果相關實習和住院醫生違反政府的復崗命令,將受到3個月吊銷醫師執照的處分。另外,相關行政處分履歷及其理由將會被記錄下來,或對今后就業產生不利影響。
評審動態
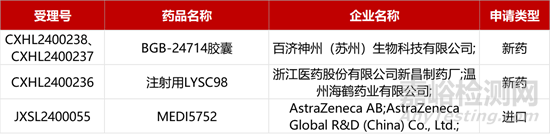
1. CDE新藥受理情況(03月05)
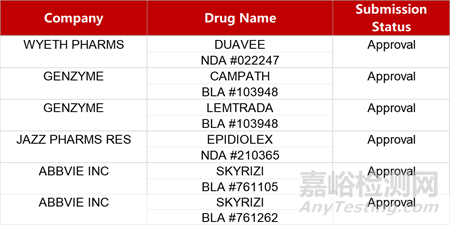
2. FDA新藥獲批情況(北美03月04日)