今日頭條
蘇庇罕見病新藥獲批上市。蘇庇醫藥IL-1R拮抗劑阿那白滯素注射液獲國家藥監局批準新適應癥,用于治療斯蒂爾病(Still’s disease)。斯蒂爾病是一種病因不明的嚴重罕見炎癥性疾病,包括成人斯蒂爾氏病(adult-onset Still’s disease,AOSD)和全身性幼年特發性關節炎(sJIA)。此前,該新藥已獲批治療冷吡啉相關周期性綜合征(CAPS)、家族性地中海熱(FMF)。
國內藥訊
1.基石PD-L1獲批新適應癥。基石藥業PD-L1單抗舒格利單抗獲國家藥監局批準新適應癥,聯合化療用于一線治療表達PD-L1(CPS評分≥5)、局部晚期或轉移性胃及胃食管結合部腺癌。在GEMSTONE-303研究中,與安慰劑聯合化療相比,舒格利單抗聯合化療明顯改善無進展生存期(中位PFS:7.6個月vs6.1個月)和總生存期(OS:15.6個月vs12.6個月)。這是該新藥在中國獲批的第五項適應癥。
2.傳奇血液瘤CAR-T獲推薦新適應癥。傳奇生物與強生開發的靶向BMCA的CAR-T療法Carvykti(ciltacabtagene autoleucel,cilta-cel)獲FDA腫瘤藥物顧問委員會(ODAC)推薦批準,用于治療至少接受過包括蛋白酶體抑制劑(PI)和免疫調節劑(IMiD)治療、復發性或難治性多發性骨髓瘤(RRMM)成年患者。在III期CARTITUDE-4研究中,與標準治療組相比,Carvyktii二線治療顯著性改善無進展生存期(HR=0.41,p<0.0001)。2022年,Carvykti已獲批用于治療至少曾接受4線以上前期治療的RRMM患者。
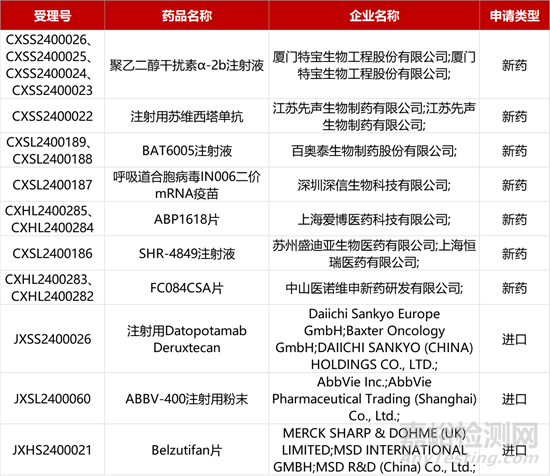
3.AZ/第一三共ADC中國報產。第一三共與阿斯利康開發的Trop2-ADC新藥Datopotamab Deruxtecan的上市申請獲得NMPA受理。本月初,該新藥已在歐盟提交兩項上市申請,用于治療局部晚期或轉移性非鱗狀非小細胞肺癌(NSCLC)經治患者;以及用于轉移性HR+、HER2低表達或陰性(IHC 0、IHC 1+或IHC 2+/ISH-)乳腺癌經治患者。該新藥用于上述兩項適應癥的Ⅲ期研究(TROPION-Breast01和TROPION-Lung01)積極結果已在ESMO23大會公布。
4.先聲再明婦科腫瘤抗體報產。先聲藥業旗下先聲再明開發的新一代VEGF抗體注射用蘇維西塔單抗的上市申請獲NMPA受理,聯合化療治療復發性卵巢癌、輸卵管癌或原發性腹膜癌。該新藥可選擇性地與人VEGF結合并阻斷其生物活性,減少腫瘤血管的生成并抑制腫瘤生長。今年年初,蘇維西塔單抗已在Ⅲ期臨床(SCORES研究)中達到主要終點,與化療聯用顯著改善患者的無進展生存期(PFS)。
5.亦諾微溶瘤病毒獲快速通道資格。亦諾微醫藥三合一溶瘤病毒產品MVR-T3011 IT(瘤內注射)獲FDA授予快速通道資格,用于治療既往鉑類化療和PD1/PDL1療法失敗的復發或轉移性頭頸部鱗狀細胞癌(HNSCC)患者。MVR-T3011基于對I型皰疹病毒的全新設計,同時攜帶表達的兩個外源性免疫調節基因PD-1抗體和IL-12,可促進腫瘤微環境的免疫反應。該療法目前正在中美兩國同步臨床開發。
國際藥訊
1.Mirum公司肝病小分子獲批新適應癥。Mirum公司口服回腸膽汁酸轉運蛋白(IBAT)抑制劑maralixibat(商品名:Livmarl)獲FDA批準補充新藥申請(sNDA),用于治療五歲及以上進行性家族性肝內膽汁淤積癥(PFIC)患者的膽汁淤積性瘙癢癥狀。在Ⅲ期MARCH研究中,Livmarl治療較安慰劑顯著改善患者瘙癢程度(p<0.0001)。此前,FDA已批準Livmarl用于治療1歲及以上Alagille綜合征(ALGS)患者的膽汁淤積性瘙癢癥。
2.BMS血癌CAR-T獲批新適應癥。百時美施貴寶CD19靶向CAR-T療法Breyanzi(lisocabtagene maraleucel,liso-cel)獲FDA加速批準新適應癥,用于三線及以上治療復發或難治性慢性淋巴細胞白血病(CLL)或小淋巴細胞淋巴瘤(SLL)患者。在I/II期臨床TRANSCEND CLL 004中,liso-cel治療的總體客觀緩解率達到45%。今年1月,該新藥的兩項sBLA被FDA授予優先審評資格,用于治療復發或難治性濾泡性淋巴瘤(FL)和套細胞淋巴瘤(MCL)經治患者。
3.FIC貧血新藥獲FDA推薦批準。Geron公司潛在“first-in-class”端粒酶抑制劑imetelstat獲FDA腫瘤學藥物咨詢委員會(ODAC)推薦批準,用于治療低風險骨髓增生異常綜合癥(MDS)的輸血依賴性貧血成年患者。在Ⅲ期IMerge研究中,與安慰劑相比,imetelstat治療第8周時顯著提高不需要輸血的患者比例(p<0.001);療效持續接近一年。FDA預計在今年6月16日前作出最終審評結果。
4.默沙東K藥宮頸癌Ⅲ期臨床積極。默沙東PD-1抑制劑Keytruda聯合放化療(CRT)治療新確診高危局部晚期宮頸癌(IB2-IIB期淋巴結陽性、III-IVA期)患者的Ⅲ期KEYNOTE-A18臨床達到主要終點。獨立數據監測委員會評估,與安慰劑與CRT組合相比,Keytruda聯合CRT顯著改善患者的總生存期(OS)。該項試驗此前已達到無進展生存期(PFS)主要終點,使疾病進展或死亡風險降低30%。此外,臨床中沒有發現新的安全信號。
5.Immuneering公司抗腫瘤新藥早期臨床積極。Immuneering公司第三代MEK抑制劑IMM-1-104治療RAS突變、晚期實體瘤的Ⅰ/Ⅱa期臨床結果積極。IMM-1-104可通過靶向MAPK通路中重要激酶MEK,以抑制MAPK通路的不正常激活。數據顯示,IMM-1-104治療有100%患者體內獲得性RAS變異的產生受到抑制;超過一半的患者觀察到目標病變消退。IMM-1-104總體耐受性良好,推薦Ⅱ期劑量(RP2D)為每日一次320mg。
6.阿斯利康收購罕見病藥物公司。阿斯利康宣布已與Amolyt Pharma達成最終協議,將以最高10.5億美元的總價收購Amolyt所有已發行股票,這包括8億美元預付款以及2.5億美元特定里程碑付款。Amolyt Pharma核心產品eneboparatide(AZP-3601)是一種治療甲狀旁腺功能減退的甲狀旁腺激素(PTH)類似物,可通過結合PTH受體的R0構象,持續升高血鈣。該新藥目前已處于III期臨床開發階段。
醫藥熱點
1.王寧利院士任河南省立眼科醫院院長。3月14日,河南省立眼科醫院院長聘任儀式舉行,聘任國際眼科科學院院士王寧利為河南省立眼科醫院院長。王寧利現年67歲,青海西寧人,長期致力于全球首位不可逆致盲眼病——青光眼的防治技術研究,是中國首位被世界青光眼聯合會授予高級兩棲臨床科學家獎的中國學者。此前,王寧利曾擔任過北京同仁醫院院長、黨委書記、中華醫學會眼科學分會主任委員等。
2.我國完成“基因編輯豬-人”肝臟異種移植。3月10日,中國科學院院士竇科峰團隊聯合空軍軍醫大學西京醫院肝膽外科主任陶開山團隊開展的異種肝臟移植臨床研究取得重大突破:成功將一只多基因編輯豬的全肝以輔助的方式移植到一位腦死亡患者體內。術中,移植肝臟恢復血流后即刻分泌膽汁,未見超急性排斥反應,已持續工作超96小時。該研究首次探索了“基因編輯豬-人”肝臟異種移植的可行性,在科學理論創新、核心技術攻關、軍事醫學應用等方面取得原創性突破。
3.兒童參加基本醫保專項行動啟動。國家醫保局會同相關部門日前印發《關于開展兒童參加基本醫療保險專項行動的通知》,重點優化新生兒童參保流程,簡化參保登記環節,鼓勵地方探索憑出生醫學證明辦理新生兒參保。《通知》明確提出力爭至2024年底,80%以上新生兒在出生當年參保;到“十四五”期末,兒童參保率穩中有升。
評審動態
1. CDE新藥受理情況(03月16日)
2. FDA新藥獲批情況(北美03月14日)