您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2024-11-08 18:17
1、 三起毒素門事件給制藥行業帶來的警醒和反思
2007年6月6日,EMA發現部分批次的抗愛滋病藥物Viracept,即奈非那韋甲磺酸鹽(1)中含有高劑量的基因毒性雜質(genotoxic impurities,GTI)甲磺酸乙酯(2)(含量超過1.1×10-3),決定召回由羅氏制藥生產的1(化合物結構見圖1)。
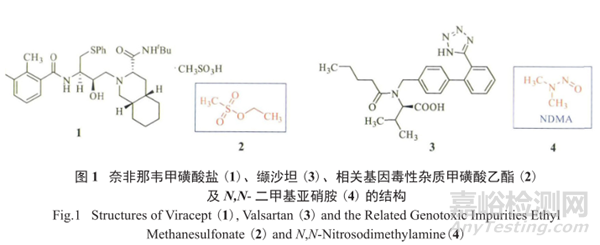
2 是潛在的致癌物質,在藥物劑量為2.5g/d的情況下,高達2.75mg的2可能被患者攝入體內,進而影響到患者的身體健康。
無獨有偶,2018年7月14日,華海制藥生產的高血壓用藥纈沙坦(valsartan,3)由于檢測出含有微量(含量大于0.3×10-6,即0.3ppm)的基因毒性雜質N, N-二甲基亞硝胺(NDMA,4),3及其相關制劑也被宣布從歐洲、美國和中國市場上召回 (化合物結構見圖1)。
不幸的是,2018年8月20日,在印度Torrent制藥生產的纈沙坦片劑中也檢測出含有 NDMA,該公司也從美國市場上自愿召回了14批次的相關藥品。
這三起毒素門事件不僅給病人帶來了安全隱患和健康問題,而且也給相關藥企帶來了不可估量的經濟損失,給整個制藥行業敲響了安全生產的警鐘。
2、 基因毒性雜質的基本概念與控制原則
基因毒性雜質是指能直接或間接損害DNA、引起基因突變或致癌的一類物質。其對 DNA的損害作用包括染色體斷裂、DNA重組及復制過程中共價鍵的插入和修飾,也包括在細胞水平上產生基因毒性物質而產生的突變。
隨著科學的進步和藥政監管的日趨完善,2006 年歐洲EMA、美國醫藥研究與制造商協會(PhRMA),2008年美國FDA先后頒發了關于基因毒性雜質限度指南 (Guideline on the Limits of Genotoxic Impurities),和一套基因毒性雜質分類、界定、檢測和風險評估的程序 ;
2014年人用藥品注冊技術要求國際協調會議(ICH)又進一步修訂了同時滿足歐美的關于基因毒性雜質的指南ICH M7,這樣對藥品進行充分的基因毒性雜質研究也成為藥品能否獲批,能否上市的關鍵因素之一。
基因毒性雜質從何而來?哪些化學物質和官能團具有潛在的基因毒性?這類物質有沒有方便判斷的警示結構(structural alerts for genotoxicity) ?
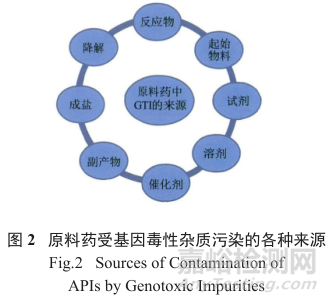
顯然,基因毒性雜質是從化學試劑、化學合成與反應作用而來的,涉及到合成工藝流程的方方面面以及隨后的藥品的穩定性和可能的降解,是一個極其復雜的過程問題( 圖2)。
在基因毒性的控制過程中,一個重要的概念就是毒理學關注閾值(threshold of toxicologicalconcern,TTC),其限度(1.5µg/d) 作為基因毒性雜質的可接受限度,低于該限度,則不能觀察到顯著的毒理作用。具體定義是:在人的一生(70歲)中,每天攝入1.5µg的基因毒性雜質,其致癌的風險是可以接受的。
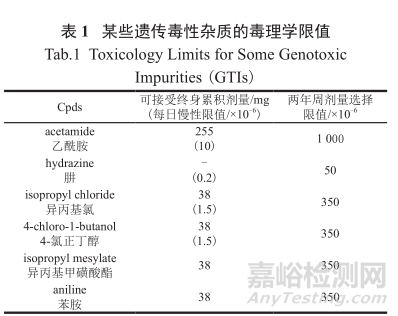
表1中列舉了一些常見的GTI的毒理學限值。例如成年正常人體對乙酰胺可接受的每日的慢性限制是攝入量小于10×10-6(即10ppm),而可接受的終生累積劑量為255 mg。
3、 可能具有基因毒性的警示結構
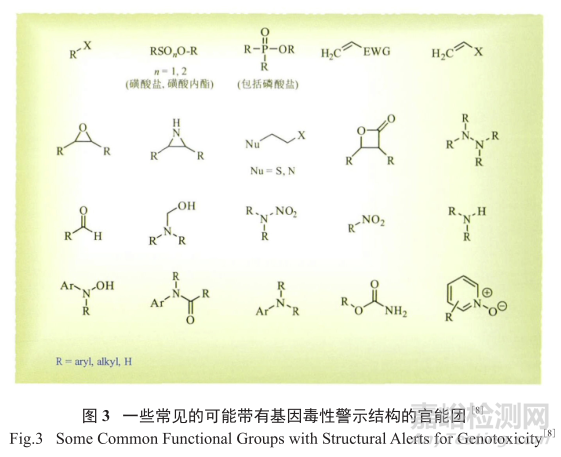
圖3列出了一些常見的帶有基因毒性警示結構的官能團,也稱為Ashby和Tennant簡化系統,這些官能團涉及到的與DNA的反應眾所周知。盡管這些結構并不詳盡,但卻是進行基因毒性雜質結構評估的基礎。
其他的結構評估商業軟件有DEREK和Mcase。當基因毒性化合物,如環氧化物或芳香胺作為反應物和試劑參與反應制備原料藥時,極有可能給最終的活性藥物成分 (API)帶來基因毒性雜質污染,因此對GTI的嚴格檢測、控制和預防在工藝化學過程中是必須的。
表2為可能帶有基因毒性警示結構的20類有機化合物。根據PhRMA的模型,由化學反應帶來的基因毒性雜質分為五類:
①已知具有遺傳毒性和致癌作用的雜質 ;
②已知具有遺傳毒性,但潛在致癌性未知的雜質 ;
③具有警示結構,但與最后的API結構無關的雜質 ;
④具有與API有關的警示結構的雜質 ;
⑤無警示結構或有足夠證據證明無遺傳毒性的雜質。

對第一類雜質要避免,甚至必須更改合成工藝 ;
對第二類、第三類雜質要進行風險評估和必要的摻雜(spiking,又譯為加標),和清除(purging)操作,跟蹤、推斷并使用TTC閾值調節機制來進行質量控制 ;
第四類和第五類雜質則可以按一般雜質來處理,即含量要低于0.1%。
從基因毒性雜質研究指南的出臺和認知接受過程(2000—2008)中可以看出,制藥工業界的認知和了解是不斷加深的,2010年OPRD(Organic Process Research & Development)期刊還專門組織發表了關于基因毒性研究的專刊,對特定上市藥物的基因毒性物質的研究也有文獻發表,表3和圖4羅列了近年來一些可能含有基因毒性雜質的常用藥品,及筆者判斷的可能來源和相應的分析方法。
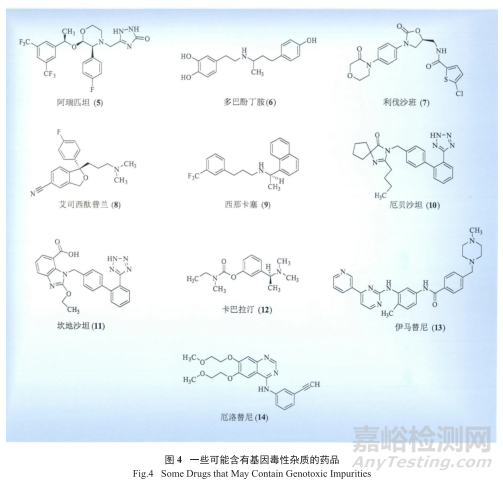
圖5是在原料藥中確定、控制和測定基因毒性雜質的流程圖(或稱之為決策樹)。從圖中不難發現該流程涉及到整個合成過程,尤其是下游的工藝化學,而且和毒理的評估、基因毒性雜質的鑒定和過程的控制方案,以及分析方法的選擇和使用緊密相關,是一個復雜細致和邏輯分析的過程。
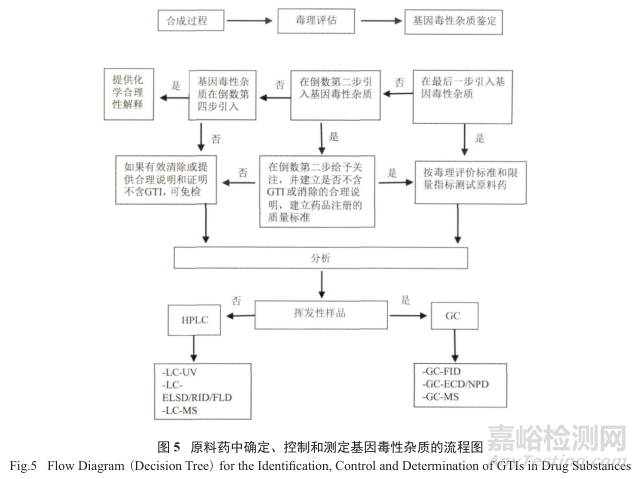
值得強調的是 :如果基因毒性雜質在最后一步中引入,則必須根椐毒理學的評估報告,設立其限制標準(極限測試 ) ;如果基因毒性雜質是在遠離最后一步反應(在4步以上)引入的,則可以通過證明后續化學工藝中每步環節的合理性,證明可有效地清除GTI來免除控制(免檢GTI)。
綜上所述,API中基因毒性雜質的來源是多方面的,從原料和反應物的化學作用形成的、并且和最終產物的構造與副反應產物結構相似相關是較為容易鑒別的,而從催化劑、試劑(不參與API構建)、反應溶劑以及產物降解帶來的基因毒性雜質有時則不易鑒定。
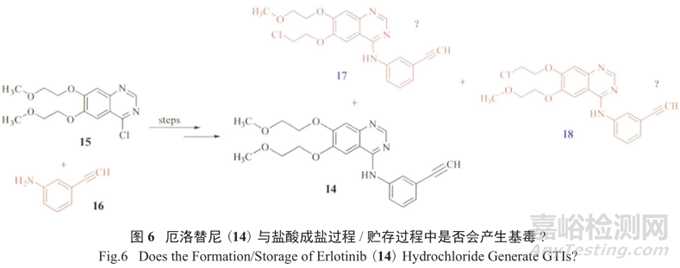
值得一提的是,要想對基因毒性雜質的產生以及可能的結構做準確的判斷,需要有很好的專業知識和理論依據作基礎,尤其需要對一些反應細節和工藝流程進行深思熟慮。例如表3中對厄洛替尼(14)的基因毒性雜質檢測只檢3-乙炔苯胺(16)是不夠的 ;
厄洛替尼在成為鹽酸鹽的過程中是否會產生基因毒性雜質17和18,以及鹽酸厄洛替尼在貯存過程中會不會降解產生17和18,都是值得關注的(圖6)。
4、 基因毒性雜質的“避免 - 控制 - 清除”(avoid-control-purge) 策略
在藥物研發和原料藥工藝控制上的應用,在工藝研究中采用“避免- 控制 -清除(ACP)”的策略(表4、表5) 能夠最大限度減少基因毒性雜質對最終產品即原料藥API 的影響。
例如美國禮來制藥(Lilly)采用的GTI(或PGI,potentially genotoxic impurities,GTI和PGI這兩個相關的名詞在許多場合往往交替使用)清除策略就很好地體現了上述原則:
1) 至少把GTI(或PGI)的生成放在離最終產物4步以外,并且在每一步分析工藝能否清除PGI的可能性 ;
2)對上述工藝進行耐受性研究和處理,在分離純化之前,通過添加(spiking) 額外的 GTI(或PGI) 來檢驗純化的強度。
例如,有時加入高達5%的GTI,然后觀察每步反應條件對該雜質的清除能力,目的是使工藝集中于起始原料或中間體的上游控制。這種方法的優點是允許控制限度設定在較高水平或可接受的程度,同時也可以使用不太復雜和靈敏度要求不是很高的分析方法 ;
3) 在倒數第二步產物檢查PGI的濃度含量,設置極限測試,驗證結果,這樣最終產品就有可能免檢GTI。


對潛在遺傳毒性雜質進行風險評估的策略就是利用質量源于設計(quality by design,QbD) 提供更詳盡的對工藝和分析的理解(圖7),最終確定雜質產生的臨界區域。
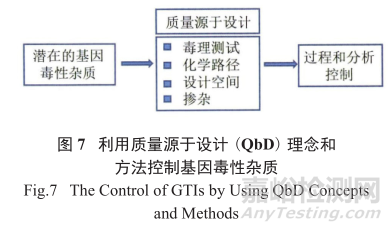
具體在生產工藝開發中,結合產品質量屬性,對相關工藝步驟進行篩選優化,通過設置工藝參數控制范圍和建立中間體驗收標準,保證工藝穩健性和產品質量一致性。
在下游工藝的開發階段,結合工藝相關基因雜質的去除效果和殘留量標準,對純化工藝關鍵參數進行驗證。通過識別確定影響最大的風險和過程參數,可以增強對產品質量和過程的控制,從而減少這些雜質的潛在影響。
這種方法要求在必要時使用毒理學測試,盡可能用化學結果來論證,用開發設計空間的多變量分析,以及使用數據來支持規范。通過強大的分析方法的支持,尤其是低水平檢測方法的開發,這一策略不僅有助于開發強大的API工藝,而且還可以識別并減小研究人員高度關注的一類雜質的風險。2012年,Madasu 等報道了商業化切實可行的氯沙坦鉀鹽(25)的五步合成方法,以55.5%的收率和99.9%的純度制備了 API(圖8)。

其亮點是在四氮唑的合成中采用了疊氮鈉,使用了N-甲基吡咯烷酮(NMP)/甲苯作為反應溶劑進行 [3+2] 偶極加成。美中不足的是反應溫度較高、反應時間長達35h ;
但整個工藝過程合理利用了疊縮工藝,避免了不必要的分離純化,經濟可行且滿足了法規要求 ;而且從氰化物到四氮唑的反應條件溫和可控,也克服了疊氮酸副產物的易爆問題。
值得強調的是,在這個工藝過程中,并沒有檢測到基因毒性雜質NDMA( 使用的偶極溶劑是NMP,沒有使用DMF),但發現含有0.02%的疊氮化物26,該化合物在處理后可以清除。
纈沙坦(3)原料藥的生產工藝中四氮唑雜環的形成是工藝的重點和難點。原有工藝存在轉化率低、 “三廢”產生量大、異構體雜質水平波動等問題。
研究人員以價廉易得的疊氮鈉代替昂貴的疊氮三烴基錫,但在芳香溶劑中存在溶解度不佳的情況,故采用溶劑DMF,這樣溶解度提高,反應速率加快,反應溫度降低,反應也更趨于安全 ;
文獻報道,改進后的工藝(圖9),轉化率提高約30%,“三廢”產生量降低約30%,異構體雜質也得到了有效控制。
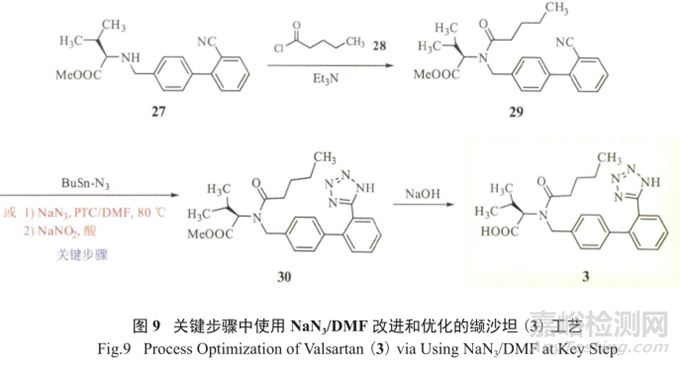
但改用DMF(溶劑中可能含有二甲胺雜質)以及隨后的用亞硝酸淬滅、調酸處理,可能引入基因毒性雜質NDMA。
如何既保留采取DMF/疊氮鈉有效快速安全地制備四氮唑的優點,同時又克服或清除 NDMA帶來的危害呢?顯然最合理的策略就是將產生NDMA的化學步驟放在整個合成序列的上游部分,給下游的后處理和控制帶來更多的機會。
令人欣喜的是,德國的Ackermann和日本的Seki分別綜述了利用Ru催化進行C-H活化,不經過經典的Suzuki偶聯反應,直接進行C-H芳基化,非常合理有效地制備了一系列沙坦類高血壓用藥(圖10)。
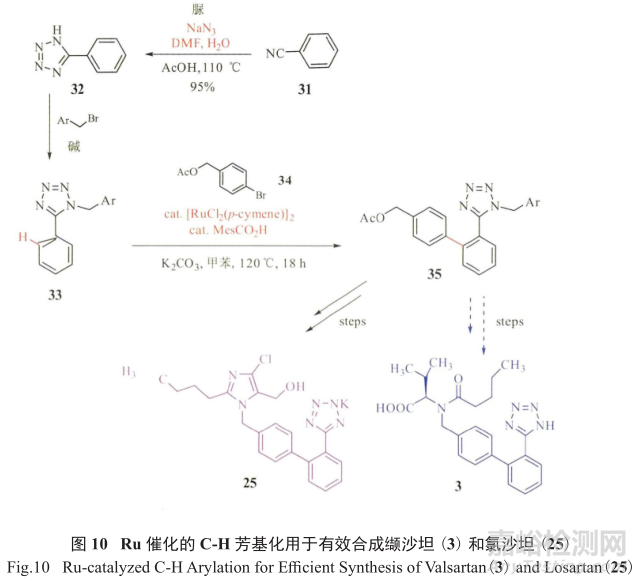
將可能產生GTI的步驟前移至工藝流程的上游部分,將有毒物質和試劑盡量遠離最終的API。另一例子是輝瑞制藥推出的第一個治療勃起功能障礙(ED)的口服藥物西地那非(又稱“偉哥”,38) 的合成工藝(圖11)。
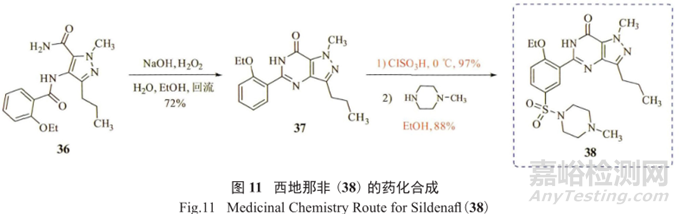
原來的合成方法將磺酰胺化放在倒數第二步,給潛在基因毒性雜質的產生(硫酸單乙酯和硫酸二乙酯)、防范和控制帶來了不小的挑戰,為此,輝瑞制藥的工藝化學家重新設計了一套符合綠色化學原理的商業化合成工藝路線(圖12),將磺酰胺化反應放在整個反應過程的第一步,取得了很好的效果。

羅氏制藥在抗腫瘤藥維莫德吉 (vismodegib,53) 研發合成工藝過程中,發現存在主要潛在基因毒性雜質50 ;同時在經氫化反應制備關鍵中間體52的過程中,發現不徹底或過度的氫化都會帶來具有警示結構的新雜質羥胺44和芳香胺48、49(圖13),給質量控制帶來了不小的挑戰。
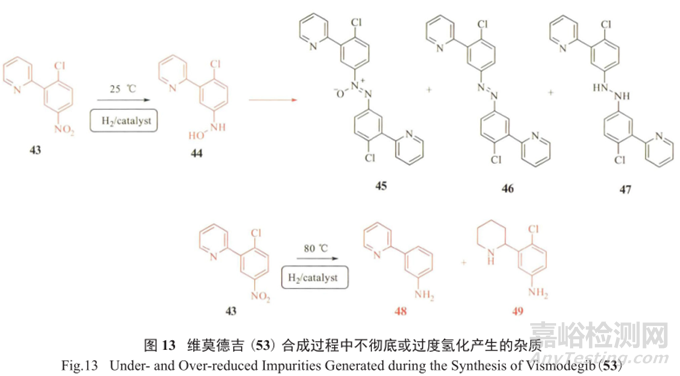
可通過優化氫化反應條件來嚴格把控潛在基因毒性中間體50。根據指導原則,每人每天的遺傳毒性雜質攝入量不能超過1.5µg,即毒理學擔憂閾值為1.5µg/d。
也就是說,從維莫德吉每天每人給藥量150mg來算,該藥物中含有的這些遺傳毒性雜質含量需要在10-5以下。在維莫德吉的合成中,合成工藝研究人員通過原料中的雜質限度控制以及改變反應條件,最終將維莫德吉原料藥中的潛在基因毒性雜質50 的含量控制在10-6以內(圖14)。

一般來說,藥物的雜質多是在合成過程中生成的副產物,其結構往往和目標分子或中間體結構類似,但不可否認,有時產生的GTI可能跟目標產物和中間體都沒有關聯。
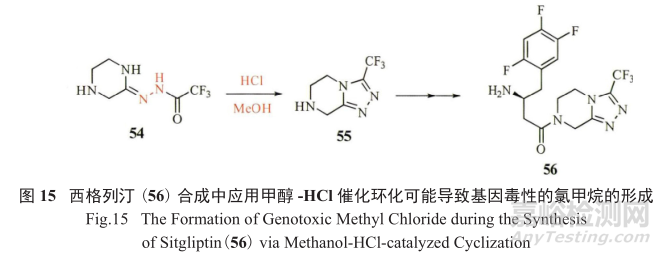
例如在抗糖尿病藥物西格列汀(56)的制備過程中(圖15),第一步甲醇和HCl的組合就有可能產生基因毒性雜質氯甲烷;在一些抗腫瘤藥物如伊馬替尼成鹽的過程中,如果使用了醇類溶劑,則可能產生相對應的甲磺酸酯GTI;
當乙腈水溶液在酸性條件下長時間加熱時,也會生成基因毒性物質乙酰胺,盡管其水溶性很好,易于排除。藥物成鹽是藥物最廣泛的存在形式,它不僅改善了藥物的理化性質,提高了藥物的溶解度和生物利用度,而且還使藥物的晶型可控,提高了藥物的穩定性。
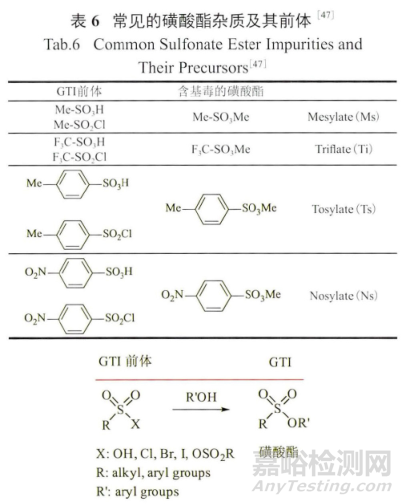
據統計,在20種常見的用于制備鹽的酸中,甲磺酸的比例高達3.2%,同時磺酸(包括三氟甲磺酸、對甲苯磺酸和對硝基苯磺酸)酯(表6)作為好的離去基團和催化劑常參與環合反應,因此如果這一類酸存在,含有被甲磺酸酯和其他的磺酸酯污染的API和最終藥品的可能性很大;所以最好能避免在醇類溶劑中成鹽,但許多藥物的最佳晶型都是在醇類溶劑中結晶出來的,而且有些反應的溶劑就是醇,這就給藥品質量控制帶來了極大的挑戰。
如何控制磺酸鹽的生成呢?一般的操作規律如下 :
①避免使用過量的磺酸 ;
②控制和嚴格把關磺酸的純度 ;
③如果需要過量的磺酸,則需要很好地控制用量,避免大過量 ;
④在成鹽和分離過程中,盡量采用切實可行的低溫條件 ;
⑤避免磺酸和醇過,早混和貯存在一起,減少磺酸與醇接觸的時間,以防磺化反應的發生 ;
⑥利用位阻大的醇,以減少酯化的可能性,如i-PrOH<EtOH<MeOH ;
⑦如果可能的話,在成鹽和分離過程中,添加少量水或用醇/水體系,將酯化的平衡移向醇和水的方向。有水存在時,在醇中生成甲磺酸酯的速度變緩。
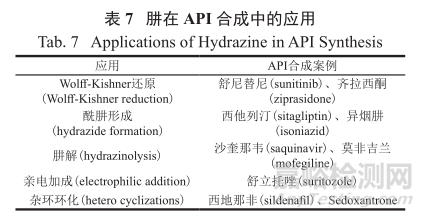
值得注意的是,有時采用基因毒性物質作為反應試劑和原料是不可避免的,例如使用肼和肼的衍生物(表7)。抗腫瘤藥物舒尼替尼(59)、抗精神病藥物齊拉西酮(60)以及抗糖尿病藥物西格列汀(56)等都使用肼作為還原劑或是作為合成關鍵雜環的原料(圖 16),一條不成文的規矩是 :盡量把肼或肼的衍生物的化學合成放在合成工藝的上游部分,這樣就能提供更多的機會將相關的基因毒性雜質控制在可控的TTC值以下。
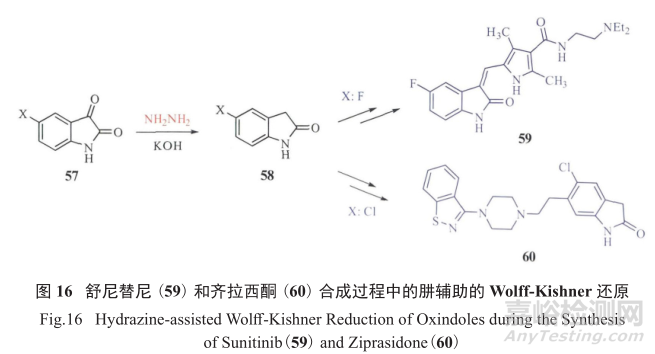
在體外試驗中發現,對甲苯磺酸異丙酯比其他磺酸酯的致誘變性更強。葛蘭素史克 (GSK)在地格列汀(denagliptin) 甲苯磺酸鹽(62)項目上就很好地利用了“控制-清除”策略來達到安全生產API 的目的:
1) 在水存在條件下脫保護,盡量減少任何生成酯的可能 ;
2) 發現對甲苯磺酸鹽粗品中含有的對甲苯磺酸異丙酯,利用重結晶 (72 ℃,1h)水解對甲苯磺酸異丙基酯(圖17)。

最近,有文獻報道了一種新型非麻醉性鎮痛藥鹽酸奈福泮(68)的公斤級合成工藝(圖 18)。
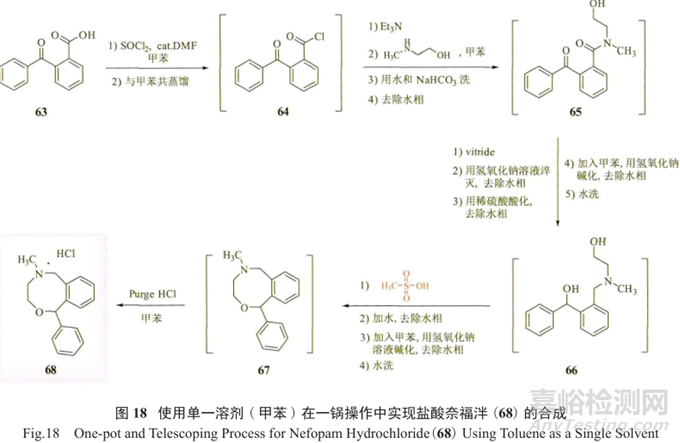
本品與阿片類藥物和其他鎮痛藥相比具有非阿片(非麻醉)和非甾體作用,副作用較少,因此作為鎮痛劑在大多數歐洲國家廣泛應用。該工藝使用單一溶劑 (甲苯)在一鍋中制備鹽酸奈福泮API,總收率良好(≥79%),純度≥99.9%。
一鍋5步合成工藝包括 :由苯甲酰苯甲酸(63)形成酰氯64,然后經酰胺化、還原、環化,最終成鹽酸鹽68。
主要優點有 :
①使用單一溶劑,
②每步轉化率均大于90%,
③成本效益高且操作便捷,
④經一鍋操作,總收率(≥79%)提高。
該工藝有如下特點 :
合理選擇了高效的還原試劑雙二氫鋁鈉(vitride,Red-Al),一步有效還原了酰胺和酮成為胺和二級醇;同時通過篩選,采用甲磺酸/甲苯條件,以“一鍋煮”的操作方式有效成環制備了API。
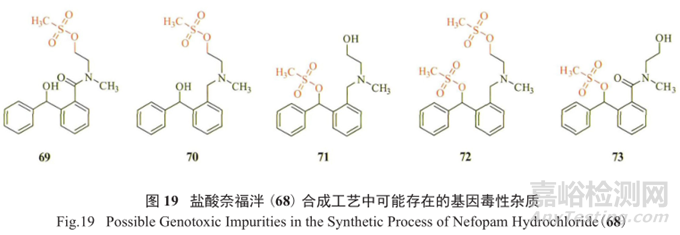
文獻稱該工藝能夠合理地避免基因毒性雜質的形成。但從最終純化68時采用了甲醇的情況以及甲磺酸的使用來看,若有潛在的基因毒性雜質69~73(圖19)的形成,則經酯交換反應,極有可能帶來甲磺酸酯這樣的GTI(注 :該文獻作者發現未知雜質經甲醇、乙醇或甲醇/水純化處理后的含量在0.01%~0.2%之間)。
葛蘭素史克(GSK)和阿斯利康 (AstraZeneca)的Elder和Teasdale對OPRD在過去10年間(2001—2010) 發表的300多篇研究論文的調查統計也高度概括和總結了當前 API的合成策略。
它再次肯定了制藥行業的普遍認知,即在復雜的、多步的藥物合成中不使用有高反應活性、有潛在誘變性的中間體是不現實的,而完全“避免”使用這些中間體則反映了對現代合成化學認識的缺乏。
根據這項調查還可得出結論 :合成一種API所需的平均步數為6步,一條合成路線的平均活性中間體數目為4;還注意到,在API合成的后期階段(即最后4個階段)中通常主要使用4種類型的反應性中間體 :烷基鹵化物、酰氯、芳族胺及邁克爾受體。
此外,無論選擇哪種途徑,反應中間體的數量仍然大致相似,這強烈挑戰了“避免”永遠是可行的選擇的觀點。上述結論也再次證明了控制,而不是回避,是絕大多數情況下最合適的策略。
很多抗腫瘤藥物都有芳香胺的結構,其中間體大多也具有芳香胺、硝基、芳香酰胺結構,按照基因毒性警示結構,這些中間體都具有基因毒性。
但是基因毒性雜質的 TTC 值是基于正常人生命周期來計算的。ICH M7明確規定 :“該指南不適用于晚期癌癥病癥指征所用原料藥和制劑”。
例如沙利度胺(thalidomide,74,圖20) 曾是一種鎮靜和止吐藥,最初于20世紀 50年代在臨床中用于治療孕吐,但由于超過10000 名嬰兒出生時患有嚴重的先天缺陷而被禁用 ;
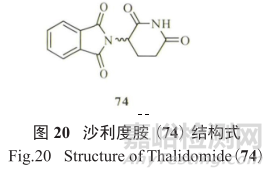
但在1998年,沙利度胺被批準用于治療多發性骨髓瘤 ;最近令人信服的支持沙利度胺的結構證據是,二羥基酞嗪的氧化代謝產物導致了 DNA 損傷。
此外,可能在某些情況下,藥物本身在治療濃度下就具有基因毒性,會使癌癥風險增加。在這種情況下,暴露在具有誘變性雜質下,不會顯著增加原料藥的癌癥風險。
因此,雜質可以被控制在非基因毒性雜質的可接受水平。這些具有警示結構的中間體在沒有明確其不是基因毒性雜質時,應該作為潛在基因毒性雜質。
如果在生產工藝開發過程中,精制后沒有檢測到這種雜質,則不需要列入質量標準中 ;如果有檢測到,則必須對其進行合理控制,甚至需要進行風險評估。
5、 結語與展望
近十年來,在藥物研發和原料藥的生產過程中,藥企和各國藥監部門對基因毒性雜質的認識和理解、控制和清除有了較為深刻的變化,發現并解決了一些原料藥中的GTI 問題,提出并較好實施了“避免 - 控制 - 清除”策略。
在新藥研發過程中,及時發現、認真對待可能出現的基因毒性雜質,通過評估風險、采用科學合理的方法來優化合成工藝是必須遵守的基本原則 :
第一,開發并使用新的合成方法和途徑,尤其是開發出新的替代試劑,將GTI的前體試劑排除在外,采用新反應媒介,避免使用或替代有基因毒性或可能致癌的溶劑 ;
第二,對反應過程和反應機理有深刻的理解,對產生潛在GTI的步驟可通過優化調整工藝化學和物理參數將GTI控制在合理的區間 ;
第三,識別和判斷相關工藝質量是否有GTI,并加以控制使其在TTC閾值以下 ;
第四,建立靈敏有效的分析方法對工藝過程進行跟蹤檢測 ;
第五,針對特殊的GTI,發展新穎有效的API純化技術。
不可否認,防控基因毒性雜質如“雞蛋里挑骨頭”一樣,是一件富有挑戰性的工作,它涉及到工藝化學、毒理學數據采集和處理評估以及化學分析方法的建立和使用。
采用“避免 - 控制 - 消除”的策略,對反應的過程包括可能的副反應要有深刻的理解,對溶劑尤其是醇類物質在成鹽過程和清潔過程的質量體系的管控也至關重要。
對藥物研發中基因毒性物質的控制既要高瞻遠矚(從反應機理層次上洞察問題),又要防微杜漸(在細節上有管控措施),做到未雨綢繆。
筆者相信,隨著對藥物研發中的質量控制和GTI的嚴控的認識和經驗的不斷豐富,一定會有更多優質的藥品造福百姓。
來源:《中國醫藥工業雜志》
原標題:《藥物研發中基因毒性雜質的控制策略與方法探索進展》
作者:張霽 ,張英俊 ,聶飚

來源:Internet


