您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-03-06 09:01
溶瘤病毒能抗腫瘤很多人多少都能理解一些。細菌用于腫瘤治療,熟悉的朋友相對少很多。但實際上,腫瘤內部是有細菌存在的,而且細菌并不是作為旁觀者無所作為,而是對腫瘤的發展、腫瘤微環境(TME)的調節發揮著重要作用。當然,細菌也有好壞之分,有的促瘤,有的則抑瘤。
活菌用于腫瘤免疫治療研究已有數十年。活菌的治療特點有別于其它抗腫瘤藥物,比如可以選擇性靶向腫瘤組織、可以到達腫瘤深處、可實現指數級增長,并能重塑腫瘤微環境,實現“冷腫瘤”向“熱腫瘤”的轉變。此外,細菌還可以進行工程改造,優化其抗腫瘤能力。
本文重點介紹下TME中細菌的特點、功能,在腫瘤進展和抑制中的作用,及臨床在研活菌產品等。
腫瘤內活菌-腫瘤相互作用
嚴格講,腫瘤內細菌的起源還不清楚。有三個可能的途徑。一是器官內的粘膜屏障在腫瘤形成過程中被破壞,使細菌得以進入腫瘤。二是考慮到腫瘤內的細菌與所在組織的細菌譜很相似,有可能在腫瘤產生之前,細菌已經在組織中存在。三是通過口腔、胃腸道系統或其它部位進入血液,隨血液移行,并最終從受損的脈管系統定植在腫瘤部位。
細菌促進腫瘤產生及進展
細菌通過多種機制促進腫瘤形成和/或進展。如下圖所示,細菌可以通過影響宿主細胞基因組穩定性促進腫瘤形成,如分泌小分子基因毒素,引起DNA破壞和突變。細菌的效應分子和粘附素可激活促瘤信號通路。細菌還可以導致持續的慢性炎癥反應,為腫瘤形成創造條件。此外,細菌還可以結合NK和T細胞表面的抑制性免疫檢查點受體。
細菌抑瘤機制
細菌發揮促瘤還是抑瘤作用,很大程度上取決于菌株類型,不同細菌的表現區別很大。如下表所示,當胰腺癌中富含假黃單胞菌(Pseudoxanthomonas,)、鏈霉菌(Streptomyces)、糖多孢菌(Saccharopolyspora)、克勞氏芽孢桿菌(Bacillus clausii)時,患者往往具備較長的生存期。有趣的是,將胰腺癌長生存期個體內的胃腸道菌群移植到其它小鼠后,同樣會增強CD8+T細胞介導的抗腫瘤免疫反應。間接說明,瘤內細菌與胃腸道微生物之間有密切聯系。當然,細菌增強免疫的機制很多,有的細菌可以激活T和NK細胞的STING通路,增加DC細胞的抗原遞呈。有的則可以增加CD8+T細胞在腫瘤細胞中的浸潤。
還有一點比較有意思。腫瘤會不停的異常表達一些抗原,有些是正常組織表達,但腫瘤表達更高的抗原。有些則是正常組織壓根不表達,腫瘤特異性表達的抗原。瘤內細菌會表達一些與腫瘤抗原表位相同的多肽,而且不只序列一樣,甚至結構和構象也相似。這就無形中增加了抗腫瘤免疫,因為有些針對抗菌的CD8+T細胞,同樣會交叉殺傷腫瘤細胞。
有些細菌還會影響現有腫瘤治療藥物的藥效。比如胰腺癌患者中,瘤內γ-變形桿菌通過表達胞苷脫氨酶使吉西他濱失活,降低該藥物的藥效。伴放線聚集桿菌也同樣會促進吉西他濱耐藥。結腸癌患者中,瘤內核梭桿菌通過選擇性下調miR-4802下游TLR-4-MYD88信號通路,誘導自噬,導致5-氟尿嘧啶和奧沙利鉑的耐藥。所以,臨床通過給予抗生素治療,抑制這些菌群的作用,會增強很多抗腫瘤藥物的治療效果。
活菌用于腫瘤的治療
了解完細菌的一些作用,再看下工業界如何利用天然活菌或者基因改造菌探索抗腫瘤應用的。
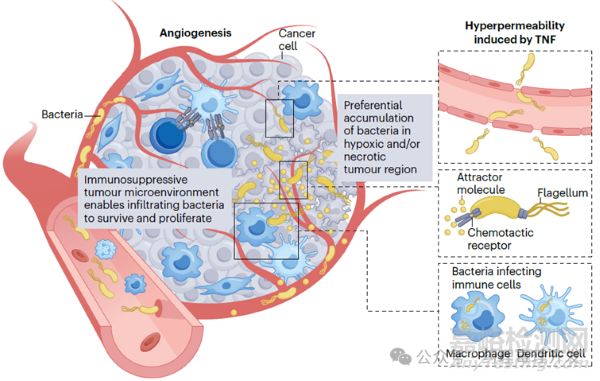
細菌經系統途徑給藥后,在血液及網狀內皮系統中濃度較高,之后數小時至數天內,被快速清除。但細菌也有其獨門絕技,可以選擇性靶向和定植在腫瘤中。如下圖所示,細菌可以通過血管,在腫瘤部位滲透到微環境中。但細菌的滲透不像其他分子,多以被動擴散為主。細菌是通過識別死亡腫瘤細胞釋放的分子,主動趨化進入腫瘤深處的。一旦在腫瘤定植后,細菌開始增殖。那細菌在非腫瘤組織也會增殖嗎?其實,很多細菌在腫瘤部位蓄積比例更高,以沙門氏菌為例,腫瘤和非腫瘤部位的比例是10000:1。其中一個原因是,腫瘤微環境是免疫抑制的,對細菌其實也是一種保護,有利于其生存。但細菌也不會無限繁殖,中性粒細胞和巨噬細胞會將其限制在一定范圍和區域。不過,如果機體中性粒細胞或巨噬細胞被耗竭,瘤內細菌就會毫無約束的擴散。
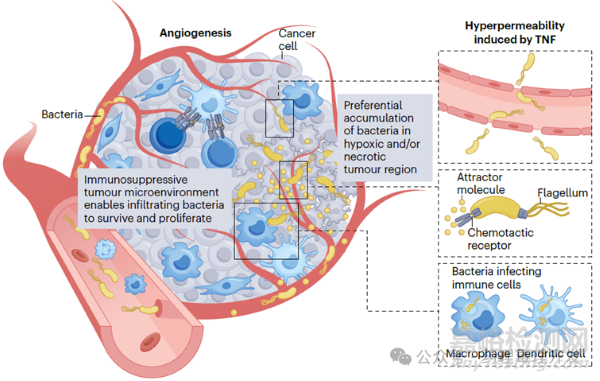
治療性細菌的作用機制
細菌可以直接殺傷腫瘤細胞。一是通過搶營養。無論腫瘤還是細菌,都是活體,都需要腫瘤微環境中的營養維持存活,細菌可以耗竭營養,導致腫瘤細胞死亡。另外,有些細菌如沙門氏菌,可以誘導腫瘤細胞凋亡和自噬。還有些細菌鞭毛成分能直接通過激活TLR5,抑制腫瘤細胞生長。李斯特菌通過增加腫瘤細胞內活性氧水平,產生直接細胞毒作用。
另外,細菌是可以進行工程改造的。通過改造,可以讓細菌表達一些具有細胞毒類作用的分子,比如cytolysin A、listeriolysin O、FAS ligand、TRAIL、TNF、Tum-5等,可以直接抑制腫瘤生長。還有些改造思路也挺有意思,細菌體內轉入可以將前藥轉化為活性代謝產物的酶,比如將5-氟胞嘧啶轉化為5-氟尿嘧啶,可以降低化療藥物的毒性,增強腫瘤部位的選擇性殺傷。細菌在腫瘤內的靶向定植其實為靶向遞送提供了很多發揮空間,除了剛才說的這些酶、配體,還可以攜帶其他影響腫瘤生長的元件,比如小RNA,又如一些抗血管(內皮抑素等)因子,通過各種機制抑制腫瘤生長,甚至殺死腫瘤細胞。此外,還可以攜帶一些免疫調節分子,比如IL-18、IL-2、IL-15、CCL21等,增強NK或CD8+T細胞活性,通過免疫系統殺傷腫瘤。最后,細菌還可以表達一些TAA(腫瘤相關抗原),增強免疫識別能力。細菌的可探索和改造的策略很多,不再一一贅述。
細菌治療腫瘤的臨床研究
分離的菌株
1891年,William Coley采用鏈球菌治療骨肉瘤,這是首次記載的將活菌用于腫瘤治療。不過,雖然看到腫瘤抑制效果,也有患者出現感染導致的死亡。后來,Coley開發了粘質沙雷氏菌和化膿性鏈球菌混合物,經加熱滅活后,給予腫瘤患者,稱為“Coley toxin”,患者生存期得以延長(8.9年vs 7.0年),但藥效只能說是中等。另外一個采用細菌產品治療腫瘤的成功案例就是減毒的BCG(卡介菌,一種牛分枝桿菌)用于治療非肌層浸潤性膀胱癌,于1990年獲FDA批準上市。
進入2000年以后,腫瘤治療細菌產品的臨床研究逐漸增多。
鼠傷寒沙門氏菌VNP20009治療轉移性黑色素瘤的Ⅰ期臨床試驗,雖然看到菌血癥的DLT反應,但總體安全性表現尚可,可惜的是雖然看到一些促炎因子的釋放及細菌的腫瘤定植跡象,但未見腫瘤出現緩解。
2023年披露的一項編碼IL-2的鼠傷寒沙門氏菌產品,與FLOFIRINOX(奧沙利鉑、鹽酸伊立替康、氟尿嘧啶、亞葉酸鈣化療組合)聯用治療轉移性胰腺癌,20例患者的中位總生存期明顯延長,是歷史對照數據的2倍(24個月vs11.1或13.1個月)。
C. novyi-NT是一款減毒的諾維氏梭狀芽胞桿菌,不表達alpha毒素,可以在腫瘤內的厭氧環境中復制。動物試驗中可看到裂解腫瘤細胞和引起炎癥反應的作用。臨床Ⅰ期研究中,瘤內注射,治療晚期實體瘤,24例患者中,42%患者看到腫瘤裂解和腫瘤負荷降低。2例患者出現4級膿毒癥,1例患者出現4級氣性壞疽的DLT。目前正在開展與PD-1抗體pembrolizumab聯用的Ⅰ期試驗(NCT03435952),首例入組的患者已經看到緩解。
李斯特菌也是臨床研究比較多的活菌之一。一項Ⅱ期臨床研究,CRS-207(一款分泌間皮素的改造的李斯特菌)與胰腺癌疫苗GVAX和環磷酰胺聯用可延長94例經治轉移性胰腺癌患者的生存期,且毒性較小。另外一項Ⅱ期臨床研究,在CRS207+GVAX+環磷酰胺組合基礎上,加上PD-1抗體nivolumab,93例轉移性胰腺癌患者,腫瘤微環境可看到CD8+T細胞擴增,腫瘤相關巨噬細胞和髓系細胞減少。不過,與不加nivolumab相比,并未見客觀緩解率和生存期的改善。CRS-207與培美曲塞和順鉑聯用治療惡性胸膜間皮瘤的Ⅰb期臨床試驗,也看到了腫瘤內T細胞擴增、CD8+T/Treg比例增加,DC和NK細胞浸潤增加,免疫抑制性M2巨噬細胞向M1轉化,但Ⅱ期臨床未見明顯獲益。ADXS-HPV也是一款改造的李斯特菌,可以分泌融合TAA(HPV16的E7抗原肽)的LLO,在一項宮頸癌Ⅱ期臨床中看到了不錯的耐受性和有效率。后續啟動了與化放療聯用治療高風險局部晚期宮頸癌Ⅲ期臨床試驗。不過試驗已經終止,原因不明。ADXS-502是一株表達22種NSCLC相關抗原的李斯特菌,與pembrolizumab聯用,在鱗狀和非鱗NSCLC中看到了46%-67%的疾病控制率。JNJ-6404757也是一款表達間皮素的李斯特菌,Ⅰ期臨床與nivolumab聯用,大部分毒性表現為輕微發熱和寒戰,另有2/12例患者出現致命的肺炎。后續未見該產品開展進一步臨床研究。
可以看到,大部分活菌抗腫瘤產品臨床主要與免疫檢查點抑制劑聯用。主要原因是細菌可通過遞送TAA或免疫調節劑,幫助重塑腫瘤微環境。不過,目前臨床數據大多還源自早期臨床,更大樣本量的研究還在進行中。
糞便移植(Faecal microbiota transplantation, FMT)
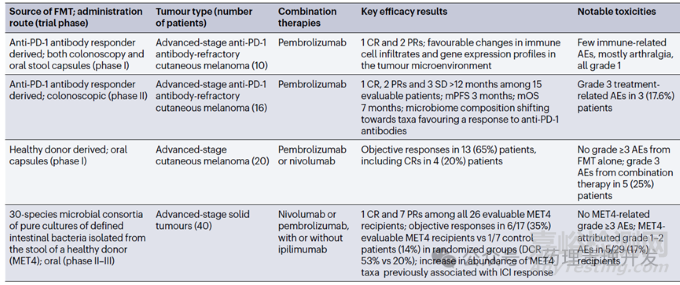
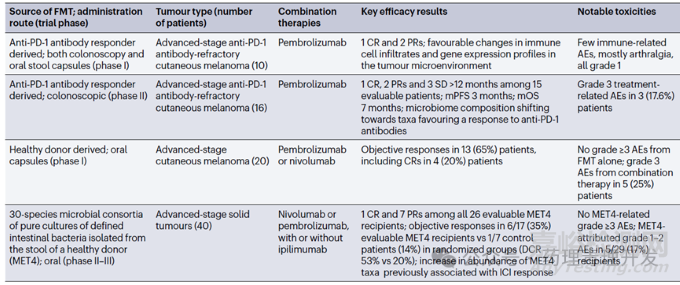
糞便移植咋一聽不怎么雅觀,或者有些離奇。但實際上,胃腸道微生物菌群可以影響腫瘤患者的免疫反應,并作為免疫治療的一種方案正在開展臨床研究。FMT是一組混合菌群,移植后會出現優勢菌群。腸道微生物組分析顯示,對FMT移植有應答的黑色素瘤患者,移植后體內富集程度最高的是厚壁菌門和放線菌門,擬桿菌門減少。FMT目前沒有太多積極的臨床數據披露。
FMT也有很多局限性,包括安全性問題,及因供體/受體等菌群標準化挑戰帶來的應用受限,廣泛推廣和普適性有難度。為克服這一問題,有團隊發明了一種有健康人糞便樣本純化得到的由30種不同細菌組成的菌群,Microbial Ecosystem Therapeutic 4(MET4),作為腸道微生物菌群移植的替代物。臨床數據顯示,MET4與免疫檢查點抑制劑聯用治療晚期實體瘤,觀察到比免疫檢查點單藥更好的藥效。FMT在研臨床試驗及結果如下表所示。
最后
抗腫瘤藥物的形式非常多樣。細菌這類活體其實在腫瘤治療方面的探索已經100多年。雖然一度進展緩慢,但2000年以后臨床研究逐漸增多。目前雖然上市的活菌類產品很少,但臨床試驗卻是很多,主要是與PD-1抗體聯用。活菌類產品面臨的主要挑戰也很多,一是作用機制不清晰,更多的是對免疫的多方面影響,如果能確定主導機制,會更有利于這類產品的開發。二是不良反應比較多。即使是減毒的細菌,依然不可避免出現一些毒性反應,比如感染,尤其是與免疫抑制化療藥物聯用,這一風險更高。三是活菌類藥物的藥代動力學與其它傳統治療藥物很不同。活菌類藥物的有效性取決于在靶部位的增殖,而不是給藥劑量。四是活菌類藥物不能通過傳統的加熱或過濾手段去除不想要的病原體,這就為GMP臨床批樣品的生產帶來很大挑戰。作為一種新型活的生物體類治療藥物,還有很多來自監管的挑戰,需要跟監管機構就樣品的生產、質控、非臨床研究等進行密切溝通。

來源:藥理毒理開發


