您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2025-03-29 10:35
|
NDA序號 |
214373 |
|
申請人 |
Theracos Sub LLC |
|
藥物名 |
Brenzavvy (bexagliflozin) 片 |
|
劑型 |
片劑 |
|
規格 |
20mg |
|
給藥途徑 |
口服 |
|
Rx/OTC分類 |
Rx |
|
適應癥 |
成人2型糖尿病控制 |
|
制劑性狀 |
藍色、膠囊形、雙凸、斜邊、薄膜包衣片,一側印有有“2”和倒置的“2”,另一側沒有印字。片劑包裝在30ct或90ct高密度聚乙烯(HDPE)瓶中,帶有(b)(4)封口(b)(4)。 |
|
存儲條件 |
在20°C至25 °C下儲存,允許在15°C至30°C之間短暫儲存。 |
生物藥劑學
Theracos Sub, LLC申請擬定的Bexagliflozin片,20毫克。為藍色薄膜涂層速釋片,在擬定的溶出方法中具有延長的體外藥物釋放特征。FDA重點審評了擬定的質量控制溶出方法和標準的可接受性。
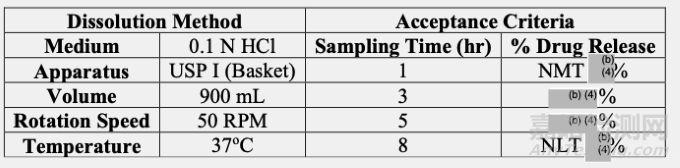
溶解方法和驗收標準:
根據所提供的信息,擬定溶出方法和溶解驗收標準是可以接受。
BCS定義
溶解度
申請人確定了原料藥Bexagliflozin在KCl/HCl緩沖液(pH 1.0)、NaOAc/HOAc緩沖液(pH 4.5)和NaOH/KH2PO4緩沖液(pH 7.6)中的飽和濃度。沒有觀察到溶解度隨pH變化而顯著變化。溶解度的平均值在37°C下16小時后為0.44、0.46和0.46mg/ml,在37°C條件下,24小時后為0.45、0.51和0.43mg/ml,pH值分別為1.0、4.5和7.6。
擬定的商業化規格為20毫克,在上述任何緩沖液中很容易溶解在250ml中,因此申請人認為,根據BCS標準,Bexagliflozin原料藥是一種高溶解性化合物。
FDA同意申請人對原料藥的溶解度定性,其滲透性為低至中。
制劑溶出方法
區分力
申請人使用擬定的溶出方法評估了Bexagliflozin片的溶出速率:20毫克規格含不同比例和等級的輔料。
增加片劑重量
申請人進行了一系列實驗,以確定增加片劑總重量對溶出曲線的影響。片劑總重量的變化涉及添加影響片劑釋放的輔料。具體見下表:
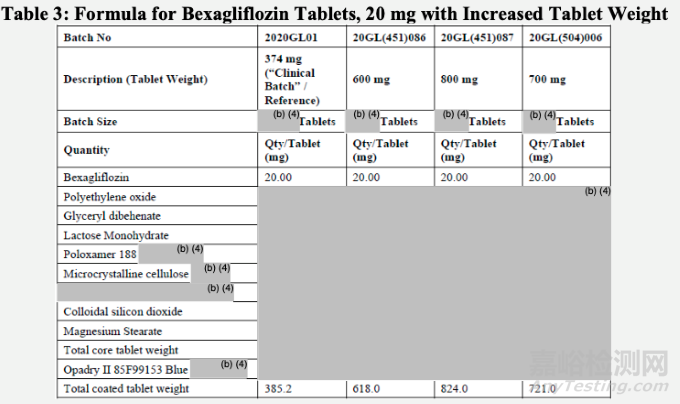
申請人觀察到,片劑重量增加,溶出會變慢,如下圖。

SUPAC級別的輔料變化
申請人進行了一系列研究,以確定SUPAC I級和II級變化對處方的影響(表4)。
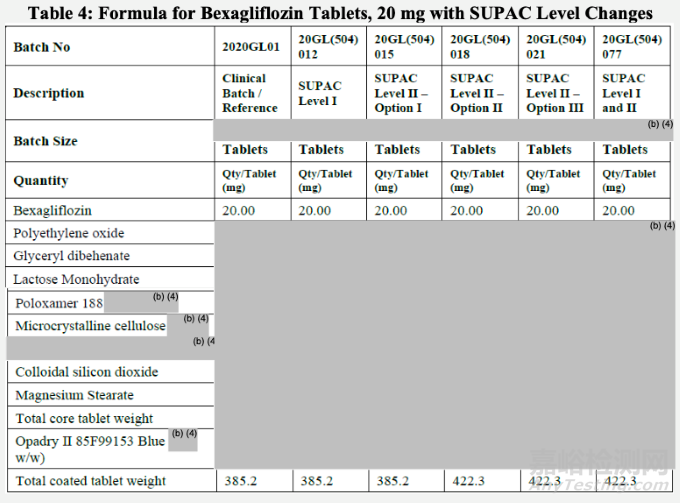
申請人觀察到了輔料的比例變化,會影響到Bexagliflozin片的溶出速率,如下圖。

申請人對擬定商業化處方中的輔料數量變化進行了額外的確認性研究。處方中心點(表5中3、4和11代表商業化處方。其他(1、2、5、6、7、8、9和10)使用表5第一行所示的可變輔料用量。
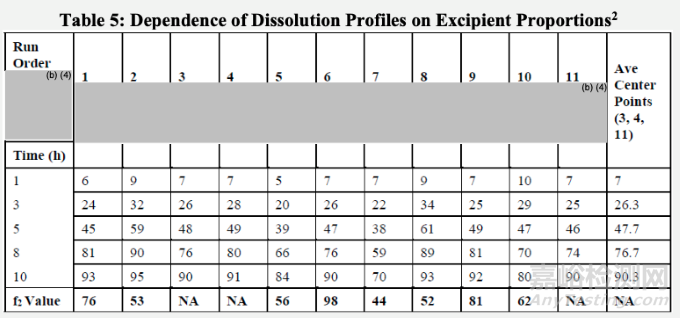
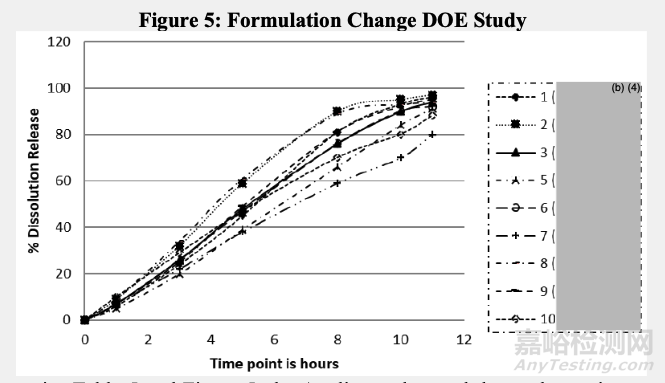
如表5和圖5所示:
申請人觀察到XX輔料數量變化,與中心點處方對比,沒有顯著影響溶出曲線。同樣,XX輔料數量的一致增加或減少(6和9),對中心點處方對比,沒有顯著影響溶出曲線。然而,XX輔料量的變化顯著影響溶出速率(2、5、7和8)。溶出方法可以用于區分這些輔料比例變化得到的制劑。
輔料PSD變化
申請人使用不同PSD大小的輔料制備得到的制劑溶出如下,發現使用大PSD的輔料得到的制劑溶出速率更快。
申請人同時使用不同級別輔料生產的制劑,溶出曲線結果表明,不同級別輔料得到的制劑溶出沒有明顯區別。
原料藥粒度大小變化
申請人使用不同PSD原料藥批次制備得到的制劑,發現溶出速率的系統性變化很小。

FDA評估:申請人充分證明了擬定溶出方法對商業化Bexagliflozin片的批次釋放和穩定性測試的適用性。擬定溶出方法顯示了對制劑中輔料比例和不同粒度輔料變化的區分能力。
擬定溶出方法(900毫升0.1 N HCl,USP方法I,50轉/分)可以滿足用于商業化制劑的質量控制。
解讀:
雖原料藥在不同pH值溶液中的溶解度不高,但基于商業化規格20mg,在250ml的緩沖液中很易溶解,因此原料藥被定義為高溶化合物。
Bexagliflozin制劑溶出方法開發,考察了不同輔料比例的制劑,不同粒度輔料的制劑,擬定溶出方法具有一定區分能力。對于不同級別輔料,不同粒度原料藥的制劑,擬定溶出方法不具有區分力。FDA認可了申請人擬定的溶出方法。

來源:Internet


