您當前的位置:檢測資訊 > 科研開發
嘉峪檢測網 2023-02-13 18:45
本文適用于一次性使用心臟固定器。根據《醫療器械分類目錄》規定,一次性使用心臟固定器編碼為03-14-02,管理類別為Ⅱ類。
一、一次性使用心臟固定器的結構組成與工作原理
心臟固定器產品通常分為吸引固定型和機械固定型。一般由調節手柄、固定卡座、萬向支撐臂、吸盤、負壓吸引管組成,也可由壓腳葉(或吸腳固定座、吸腳)、負壓連接管、三通閥、定向夾頭組件、調節臂、固定座、調節手柄、旋柄、內穿拉緊鋼絲組件組成。
常見產品及組件舉例如下圖:

圖1一次性使用心臟固定器


圖2圖3吸引固定型壓腳葉
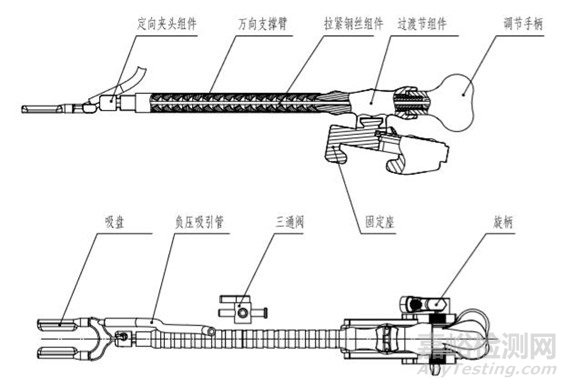
圖4心臟固定器組件名稱
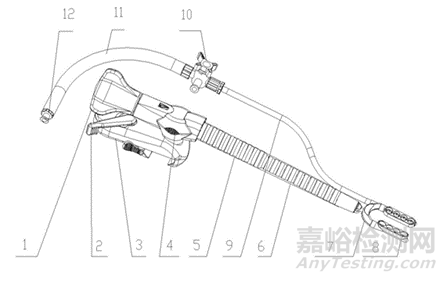
1.旋柄;2.鎖緊旋鈕;3.固定卡座;4.轉動架;5.調節臂;6.護套管;7.U型壓腳固定座;8.U型壓腳(或稱吸盤、吸腳);9.前端吸管;10.三通;11.后端吸管;12.魯爾接頭
心臟固定器產品主要通過活動調節臂支撐一固定終端,按壓在心臟表面,采用負壓吸引方式或機械壓迫方式,在心臟不停跳的情況下,對心臟手術區域進行固定,提供相對穩定的手術操作視野。
二、一次性使用心臟固定器的主要風險
除無源醫療器械已識別的共性風險外,對于心臟固定器產品,至少還需關注以下方面的風險:
(1)生物或化學危害
產品材料的選擇未經過生物學評價,生物不相容材料接觸患者,造成患者刺激過敏等癥狀,損害患者健康;生產過程中原材料、包裝材料等微生物的污染,導致產品菌落超標,產品滅菌不徹底,或生產環境的微生物超標,導致滅菌不徹底,產品帶菌,導致細菌進入人體,患者被細菌感染,嚴重時導致發熱、休克。
(2)操作危害
與牽開器不配套,不能固定在支架上,無法進行手術操作,延誤治療,影響手術效果。
(3)滅菌
(若采用環氧乙烷滅菌)對環氧乙烷殘留量的控制未確認,或未能按確認的結果實施控制,解析不徹底,致使環氧乙烷殘留量超標,超量的環氧乙烷輸入人體,損害患者健康。
三、一次性使用心臟固定器性能研究實驗要求
1、產品技術要求應包括但不局限于以下內容:
1.1外觀
心臟固定器產品應明確外觀要求。產品外觀一般應光滑,表面應無非設計預期的鋒棱、裂紋、毛刺等。
1.2尺寸
心臟固定器產品的壓腳葉、調節臂、固定卡座等組件的尺寸及允差,在臨床使用中對于穩定心臟靶血管區域、提供手術操作空間具有重要作用,應明確上述關鍵組件的尺寸及允差。
1.3耐腐蝕性
心臟固定器產品應明確其耐腐蝕性的要求。產品中不銹鋼材料組件的耐腐蝕性能應至少符合相關標準(如YY/T 0149)中5.4b級的規定。
1.4吸引組件的性能
心臟固定器產品中設有內腔預期可進行吸引的組件,應明確其通暢性、組件牢固性能、耐負壓性能等要求。如負壓吸引管、壓腳葉等組件的內孔應暢通,不得有堵塞現象;負壓吸引管路組件連接部位應牢固可靠;三通閥組件應開閉靈活,在打開狀態下,壓腳葉、負壓吸引管等組件在承受企業設定的負壓值并保持一定時間,不得出現扁塌或變形,且心臟固定器能吸引一定重量的物件,保持一定時間不脫落,在三通閥關閉狀態下,應能有效阻斷氣路。
1.5化學性能
心臟固定器產品中直接和間接接觸人體組織的組件應明確其化學性能要求。化學性能包括重金屬、酸堿度、蒸發殘渣、還原物質、紫外吸光度、EO殘留量(如適用)等。
1.6生物性能
心臟固定器產品通過一個已驗證的滅菌過程后應無菌。
1.7其他
為了保證器械安全有效而設定的其他性能,應能滿足使用要求。
產品的檢驗方法應根據技術性能指標設定,檢驗方法應優先采用公認的或已頒布的標準檢驗方法;如果沒有現行的標準檢驗方法可采用時,規定的檢驗方法應具有可操作性和可重現性。
2、一次性使用心臟固定器性能研究
應當開展產品性能研究以及產品技術要求的研究,應至少對產品的代表性樣件進行功能性、安全性指標研究,如配合性能、使用性能等。應對產品的整體性能及在模擬臨床使用的情況進行評價,若通過臺架試驗不能確認產品風險控制措施有效性時,必要時可開展動物試驗研究。開發人應明確與質量控制相關的其他指標的確定依據,所采用的標準或方法、采用的原因及理論基礎。
3、生物相容性的評價研究
心臟固定器直接與人體組織接觸,應按照GB/T 16886系列標準對產品進行全面的生物學評價,證明其安全性。在進行生物評價過程中,應明確心臟固定器與人體接觸組件或部位的材料性質,如材料牌號、化學成分、生產加工中引入加工助劑等。
生物相容性評價研究應當包括:明確生物相容性評價的依據和方法;明確產品所用材料及與人體接觸的性質;明確實施或豁免生物學試驗的理由和論證;對于現有數據或試驗結果的評價。
4、產品滅菌工藝研究
4.1應明確滅菌工藝(方法和參數)及其選擇依據和無菌保證水平(SAL),并精選滅菌確認。心臟固定器的無菌保證水平(SAL)應達到1×10-6。
4.2殘留毒性:若滅菌使用的方法容易出現殘留,應當開展研究明確殘留物信息、控制標準及處理方法。
5、產品有效期/使用期限和包裝研究
可參考《無源植入性醫療器械貨架有效期注冊申報資料指導原則》對心臟固定器貨架有效期和包裝完整性進行研究。
貨架有效期的驗證試驗通常可分為加速穩定性試驗和實時穩定性試驗。可分析產品是否適用于加速老化,若適用,可采用加速老化研究作為貨架有效期的支持性研究。老化方案和報告中宜明確具體老化條件,如實時老化溫度、濕度、時間;加速老化溫度、濕度、環境溫度(TRT)、時間等。明確老化方案中驗證項目、驗證方法及接受標準、取樣時間點及各項目樣品數量的確定依據和相關研究。
貨架有效期驗證項目包括產品自身性能和包裝系統性能兩方面。產品自身性能驗證需選擇與心臟固定器貨架有效期密切相關的物理、化學項目,包括耐腐蝕性。涉及產品生物相容性可能發生改變的產品,需進行生物學評價。包裝系統性能驗證根據適用情況可選擇目力檢測包裝密封完整性、染色液穿透法測定透氣包裝的密封泄漏、氣泡法測定軟性包裝泄漏、軟性屏障材料密封強度、無約束包裝抗內壓破壞、微生物屏障等試驗。
產品包裝完整性除考慮儲存條件外,還需考慮運輸條件,根據適用情況可選擇人工搬運、堆碼、振動、低氣壓、集中沖擊等模擬運輸試驗驗證包裝系統性能。

來源:嘉峪檢測網


