您當(dāng)前的位置:檢測(cè)資訊 > 科研開發(fā)
嘉峪檢測(cè)網(wǎng) 2024-06-04 17:28
基因毒性雜質(zhì)(genotoxic impurity,GTI)是指藥物中能直接或間接導(dǎo)致DNA受損引起基因突變,并具有致癌性或者潛在致癌可能性的一類雜質(zhì)。由于其較一般雜質(zhì)具有微量水平就存在潛在致突變性和致癌性風(fēng)險(xiǎn)的特點(diǎn),受到藥品監(jiān)管機(jī)構(gòu)和制藥企業(yè)重點(diǎn)關(guān)注和嚴(yán)格控制。
2002年歐洲藥物管理局(EMA)最先出臺(tái)了關(guān)于基因毒性雜質(zhì)的管理法規(guī),美國(guó)食品藥物管理局(U.S. FDA)、國(guó)際人用藥品注冊(cè)技術(shù)要求國(guó)際協(xié)調(diào)會(huì)(ICH)等組織也針對(duì)基因毒性雜質(zhì)先后頒發(fā)了相關(guān)界定、分類、限度、檢測(cè)和風(fēng)險(xiǎn)評(píng)估程序等一系列指南,目前已經(jīng)成為藥品獲批及上市的關(guān)鍵指標(biāo)之一。
我國(guó)對(duì)基因毒雜質(zhì)的管理要求
國(guó)家食品藥品監(jiān)督管理局于2016年發(fā)布的《化學(xué)藥品新注冊(cè)分類申報(bào)資料要求(試行)》(2016年 第80號(hào))中提到過“結(jié)合起始原料和本品的制備工藝,簡(jiǎn)述對(duì)原料藥可能存在的基因毒性雜質(zhì)所進(jìn)行的分析和研究的結(jié)果,并按照ICH M7指導(dǎo)原則的要求說(shuō)明控制的策略”。
我國(guó)藥監(jiān)部門于2017年6月加入ICH,后續(xù)2020版中國(guó)藥典四部通則部分,添加了《9306遺傳毒性雜質(zhì)控制指導(dǎo)原則》,該指導(dǎo)原則的內(nèi)容要求與ICH M7基本一致。
2024年1月5日,國(guó)家藥品監(jiān)督管理局發(fā)布了決定使用《M7(R2):評(píng)估和控制藥物中DNA反應(yīng)性(致突變)雜質(zhì)以限制潛在致癌風(fēng)險(xiǎn)》國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)指導(dǎo)原則的公告。國(guó)內(nèi)醫(yī)藥企業(yè)對(duì)于相關(guān)藥品遺傳毒性雜質(zhì)的控制也應(yīng)符合M7(R2)的指導(dǎo)要求。
基因毒性警示結(jié)構(gòu)
所謂警示結(jié)構(gòu)單元是指一些具有與遺傳物質(zhì)發(fā)生化學(xué)反應(yīng)能力的特殊結(jié)構(gòu)單元,會(huì)誘導(dǎo)基因突變或者導(dǎo)致染色體重排或斷裂,從而具有潛在的致癌風(fēng)險(xiǎn)。警示結(jié)構(gòu)單元是遺傳毒性雜質(zhì)識(shí)別的起點(diǎn)。具有警示結(jié)構(gòu)單元,但并未經(jīng)實(shí)驗(yàn)測(cè)試模型驗(yàn)證的雜質(zhì)叫做潛在遺傳毒性雜質(zhì)。常見警示結(jié)構(gòu)單元如圖1:
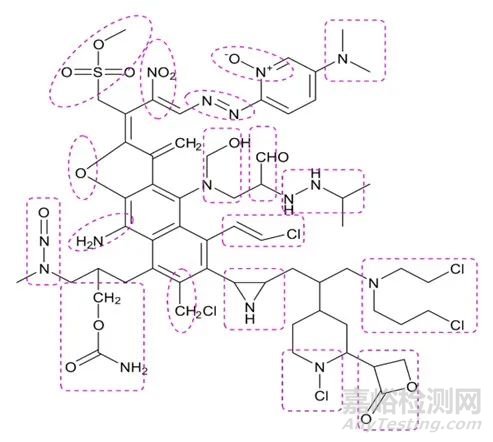
圖1 常見警示結(jié)構(gòu)單元
可以發(fā)現(xiàn),以上結(jié)構(gòu)單元大部分都含有氨氮結(jié)構(gòu),其中亞硝胺類就是比較常見的一種基因毒雜質(zhì)。
自2018年7月在纈沙坦原料藥中檢出N-亞硝基二甲胺(NDMA)以來(lái),陸續(xù)在其他沙坦類原料藥中檢出了各類亞硝胺雜質(zhì),如NDMA、N-亞硝基二乙胺(NDEA)等。進(jìn)一步的調(diào)查發(fā)現(xiàn),在個(gè)別供應(yīng)商的非沙坦類的藥物中(如雷尼替丁),亦有亞硝胺類雜質(zhì)的檢出。亞硝胺類雜質(zhì)屬于ICH M7(R1)(《評(píng)估和控制藥物中DNA反應(yīng)性(致突變)雜質(zhì)以限制潛在致癌風(fēng)險(xiǎn)》)指南[1]中提及的“關(guān)注隊(duì)列”物質(zhì)。根據(jù)世界衛(wèi)生組織公布的致癌物清單[2],NDMA和NDEA均屬于2A類致癌物質(zhì);根據(jù)國(guó)際認(rèn)可數(shù)據(jù)庫(kù),已有部分亞硝胺類雜質(zhì)有公開的致癌性數(shù)據(jù),如NDMA、NDEA、N-亞硝基-N-甲基-4-氨基丁酸(NMBA)、N-亞硝基二丁胺(NDBA)等。
隨著對(duì)亞硝胺類雜質(zhì)的日益關(guān)注,美國(guó)藥典(USP)也在不斷更新亞硝胺藥物分析雜質(zhì),目前總計(jì)達(dá)到49種,簡(jiǎn)單亞硝胺和NDSRIs的雜質(zhì)清單還在持續(xù)豐富中。為了保證藥品的安全和質(zhì)量可控,實(shí)現(xiàn)有效的風(fēng)險(xiǎn)控制,提供更加可靠的數(shù)據(jù)支持[3]。
亞硝胺類雜質(zhì)來(lái)源
根據(jù)目前所知,亞硝胺類雜質(zhì)有多種產(chǎn)生原因[4],如工藝產(chǎn)生、降解途徑和污染引入等。具體來(lái)講,亞硝胺類雜質(zhì)可能通過以下途徑引入[5]:
(一)由工藝引入亞硝胺類雜質(zhì)的風(fēng)險(xiǎn)
以沙坦類藥物的合成為例,四唑的環(huán)化是由有機(jī)腈與疊氮化鈉的環(huán)加成反應(yīng)在高沸點(diǎn)溶劑(如二甲基甲酰胺或者N-甲基吡咯烷酮)中實(shí)現(xiàn)的,反應(yīng)結(jié)束后,過量的疊氮化鈉用亞硝酸鈉淬滅。然而在這個(gè)過程中使用的二甲基甲酰胺和N-甲基吡咯烷酮中分別含有二甲胺和4-甲氨基丁酸雜質(zhì)(這些雜質(zhì)即可能是這些溶劑的合成原料,也可能是溶劑分子降解的產(chǎn)物)。這些仲胺在疊氮化鈉的淬滅反應(yīng)中與淬滅劑亞硝酸鈉作用,產(chǎn)生了相應(yīng)的亞硝胺NDMA (二甲基亞硝胺) 和NMBA (N-亞硝基-N-甲基-4-氨基丁酸)。
這個(gè)過程是沙坦類藥物產(chǎn)生亞硝胺雜質(zhì)的根本原因(圖2)。尤其是考慮到疊氮化鈉淬滅是整個(gè)沙坦合成工藝的最后一步,產(chǎn)生的亞硝胺雜質(zhì)污染最終產(chǎn)品的可能性大大增加。


圖2 沙坦類藥物可能引入亞硝胺類雜質(zhì)過程示例
(二)由污染引入的風(fēng)險(xiǎn)
原料藥生產(chǎn)過程中使用了被亞硝胺類雜質(zhì)污染的物料(起始物料、中間體、溶劑、試劑、催化劑等)可能帶來(lái)亞硝胺類雜質(zhì)的風(fēng)險(xiǎn)。
使用回收的物料亦有引入亞硝胺類雜質(zhì)的風(fēng)險(xiǎn)。已發(fā)現(xiàn)的回收物料被亞硝胺污染的實(shí)例包括鄰二甲苯、氯化三丁基錫(用作疊氮化三丁基錫的來(lái)源)、N,N-二甲基甲酰胺(DMF)。
(三)降解產(chǎn)生風(fēng)險(xiǎn)
某些藥物本身會(huì)降解產(chǎn)生亞硝胺類雜質(zhì),如雷尼替丁在高溫下會(huì)產(chǎn)生亞硝胺類雜質(zhì)[6];氨基比林中二甲氨基自身水解也會(huì)生成二甲基亞硝胺(圖3)。

圖3 氨基比林降解導(dǎo)致二甲基亞硝胺形成的機(jī)理
(四)制劑過程中形成
2019年9月,一份新的二甲基亞硝胺和二乙基亞硝胺產(chǎn)生機(jī)理報(bào)告被遞交到了監(jiān)管部門。該報(bào)告提出,NDMA/NDEA似乎是在蓋箔印刷過程中形成的,N-亞硝胺的形成是由蓋箔中的硝化纖維素與含胺印刷油墨(二甲胺和二乙胺)反應(yīng)引起的,并通過汽化和冷凝熱封起泡過程轉(zhuǎn)移到在成品上。由于增塑硝化纖維碎片的爆燃溫度,在熱誘導(dǎo)分解時(shí)會(huì)產(chǎn)生不同的氮氧化物。從硝酸纖維素中釋放出氮氧化物以及隨后在印刷藥物油墨中對(duì)胺進(jìn)行亞硝化被認(rèn)為是合理的。
針對(duì)以上產(chǎn)生途徑,F(xiàn)DA在2024年4月11日-12日組織的年度仿制藥論壇中,也給API生產(chǎn)商提出了如下建議:
從整體上評(píng)估原料藥合成路線,規(guī)避亞硝胺類在反應(yīng)中產(chǎn)生,或?qū)⒖赡苄越档阶畹停?/span>
對(duì)原材料和中間供應(yīng)商進(jìn)行評(píng)估和審計(jì),如果發(fā)現(xiàn)亞硝胺雜質(zhì)的風(fēng)險(xiǎn),應(yīng)使用高靈敏度且經(jīng)過驗(yàn)證的方法進(jìn)行確認(rèn);
如果檢測(cè)到亞硝胺類物質(zhì),應(yīng)進(jìn)行根本原因分析,必要時(shí)變更生產(chǎn)工藝,以防止/減少亞硝胺類物質(zhì)的生成;
如實(shí)向FDA報(bào)告進(jìn)行變更的內(nèi)容
亞硝胺類基因毒雜質(zhì)控制策略
(一)基本控制理念
由于亞硝胺類雜質(zhì)在人體中可接受限度較小,微量雜質(zhì)的檢測(cè)和控制難度大。因此對(duì)于亞硝胺類雜質(zhì)的控制應(yīng)采取避免為主,控制為輔的策略。
1)避免為主是指在藥品的研發(fā)階段應(yīng)根據(jù)亞硝胺類雜質(zhì)產(chǎn)生的原因從原料藥工藝路線的選擇、物料的選擇與質(zhì)控、工藝條件的優(yōu)化等方面盡量避免亞硝胺類雜質(zhì)的產(chǎn)生,并在生產(chǎn)過程中嚴(yán)格執(zhí)行各操作規(guī)范。藥品上市許可持有人/藥品生產(chǎn)企業(yè)應(yīng)與各物料(原料藥應(yīng)包括起始物料、溶劑、試劑、催化劑、中間體等,制劑應(yīng)包括原料藥、輔料、包材等等)生產(chǎn)商充分溝通,對(duì)物料生產(chǎn)和回收工藝進(jìn)行系統(tǒng)評(píng)估。
若評(píng)估發(fā)現(xiàn)有生成亞硝胺類雜質(zhì)的風(fēng)險(xiǎn),應(yīng)首先分析亞硝酸鹽或者可能形成亞硝胺類雜質(zhì)的相關(guān)試劑和溶劑在工藝中使用的必要性,盡量避免選擇可能生成亞硝胺類雜質(zhì)的生產(chǎn)工藝[6]。
2)控制為輔的策略是指當(dāng)評(píng)估藥品具有亞硝胺類雜質(zhì)殘留風(fēng)險(xiǎn)且相關(guān)工藝無(wú)法避免時(shí),應(yīng)盡可能將該步驟調(diào)整至工藝的早期,利用后續(xù)多步驟的操作降低亞硝胺類雜質(zhì)殘留風(fēng)險(xiǎn)。同時(shí)須根據(jù)工藝路線分析可能生成的亞硝胺結(jié)構(gòu),并優(yōu)化工藝,制定詳細(xì)的過程控制策略,保證生產(chǎn)過程中此類雜質(zhì)的有效去除。
由降解產(chǎn)生亞硝胺類雜質(zhì)的情況,應(yīng)分析降解產(chǎn)生的條件,通過優(yōu)化生產(chǎn)工藝、處方、貯存條件等,降低降解雜質(zhì)的產(chǎn)生風(fēng)險(xiǎn)。
(二)限度控制
藥物中亞硝胺類雜質(zhì)的控制策略建議參考ICH M7(R1)指南的相關(guān)規(guī)定,應(yīng)保證最終擬定的控制策略和雜質(zhì)限度具有充分合理的科學(xué)依據(jù)。亞硝胺類雜質(zhì)的致癌風(fēng)險(xiǎn)較高,不適合按照ICH M7(R1)提出的1.5μg/天的毒理學(xué)關(guān)注閾值(TTC)控制限度。
1)應(yīng)使用來(lái)自研究設(shè)計(jì)完善的致癌性試驗(yàn)中的最低TD50值,或與人類風(fēng)險(xiǎn)評(píng)估最相關(guān)的種屬、性別和腫瘤發(fā)生器官部位的最低TD50值來(lái)計(jì)算可接受攝入量,設(shè)定對(duì)應(yīng)腫瘤發(fā)生風(fēng)險(xiǎn)為十萬(wàn)分之一,人體體重統(tǒng)一按50kg計(jì)算,則該亞硝胺類雜質(zhì)的每日可接受攝入量(Acceptable Intake,AI)為:TD50(mg/kg/天)×50kg/50000。
2)未能在權(quán)威機(jī)構(gòu)數(shù)據(jù)庫(kù)中查詢到TD50值時(shí),可選用以下幾種方法分別獲得該亞硝胺類雜質(zhì)的控制限度,并建議取其中最小值:
A.可以參考國(guó)際權(quán)威機(jī)構(gòu),如WHO、國(guó)際化學(xué)品安全性方案(International Programme on Chemical Safety,IPCS)等公布的數(shù)據(jù)或建立的風(fēng)險(xiǎn)評(píng)估方法。
B.與已有TD50值的亞硝胺類雜質(zhì)結(jié)構(gòu)相似,可以導(dǎo)用其TD50值計(jì)算雜質(zhì)限度。
(三)檢測(cè)方法的建立
藥物中亞硝胺類雜質(zhì)的分析測(cè)試方法,可以參考權(quán)威機(jī)構(gòu)發(fā)布的方法,亦可自行開發(fā)方法,均需注意分析方法靈敏度應(yīng)與所論證的雜質(zhì)限度相匹配,并采用雜質(zhì)對(duì)照品進(jìn)行完整的方法學(xué)驗(yàn)證,保證亞硝胺類雜質(zhì)能夠準(zhǔn)確有效的檢出。若采用自行開發(fā)方法,需證明該方法等效于或者更優(yōu)于同品種官方公布的方法。
(四)全生命周期的風(fēng)險(xiǎn)控制
對(duì)于申報(bào)上市的產(chǎn)品,申請(qǐng)人在研發(fā)中,應(yīng)進(jìn)行亞硝胺類雜質(zhì)的風(fēng)險(xiǎn)評(píng)估,對(duì)明確有亞硝胺類雜質(zhì)潛在風(fēng)險(xiǎn)的品種應(yīng)進(jìn)行充分的研究,在申報(bào)資料的相應(yīng)章節(jié)提交亞硝胺類雜質(zhì)的研究資料及檢測(cè)結(jié)果,同時(shí)應(yīng)注意用于研究的樣品的批次、批量必須具有代表性以及科學(xué)依據(jù)。
對(duì)于已上市藥品,藥品上市許可持有人/藥品生產(chǎn)企業(yè)也應(yīng)主動(dòng)對(duì)于亞硝胺類雜質(zhì)存在的風(fēng)險(xiǎn)進(jìn)行評(píng)估,若存在潛在的亞硝胺類雜質(zhì)產(chǎn)生風(fēng)險(xiǎn),可參照本指導(dǎo)原則以及其他相關(guān)指導(dǎo)原則的要求進(jìn)行研究,根據(jù)研究結(jié)果采取相應(yīng)的措施,以防止或最小化患者亞硝胺類雜質(zhì)的暴露。
參考文獻(xiàn)
1. ICH M7(R1) Assessment and control of DNA reactive (mutagenic) impurities in pharmaceuticals of limit potential carcinogenic risk [EB/OL] (2017-03-31)
2. 世界衛(wèi)生組織國(guó)際癌癥研究機(jī)構(gòu)致癌物清單,http://samr.cfda.gov.cn/WS01/CL1991/215896.html
3. 美國(guó)藥典官方網(wǎng)站, https://www.usp.org/
4. (a) Assessment report, 14 February 2019, EMA/217823/2019. (b)A Screening Procedure for the Formation of Nitroso Derivatives and Mutagens by Drug-Nitrite Interaction, Chem. Pharm. Bull. 1982, 30(9), 3399-3404. (c) Formation of N-Nitrosodimethylamine (NDMA) from Dimethylamine during Chlorination, Environ. Sci. Technol. 2002, 36, 588-595. (d) N-nitrosomethylanlaniline, Org. Synth. 1933, 13, 82. (e) Nitrosomethylurea. Org. Synth. 1935, 15, 48.
5. (a) Information on nitrosamines for marketing authorisation holders,EMA/189634/2019. (b) Questions and answers on “Information on nitrosamines for marketing authorisation holders”,EMA/CHMP/428592/2019 Rev.1
6. Questions and Answers: NDMA impurities in ranitidine (commonly known as Zantac),
https://www.fda.gov/drugs/drug-safety-and-availability/
7. Inhibition of Nitrosamine Formation by Inorganic and Organic Salts, Chem Pharm Bull, 1986, 34(8), 3485-3487.

來(lái)源:Internet


