您當前的位置:檢測資訊 > 實驗管理
嘉峪檢測網 2024-06-06 15:25
細菌內毒素是革蘭陰性菌細胞壁外膜中的一種組分,主要成分是脂多糖,后者由細菌細胞壁合成后轉運到細胞表面,細菌死亡或自溶后會從細菌細胞結構中釋放出來,能導致人體發熱、休克甚至死亡。
革蘭陰性菌的典型菌群有大腸桿菌、傷寒桿菌、淋球菌、腦膜炎球菌、志賀菌、結核桿菌,痢疾桿菌等。這類菌群的致熱性除全菌體和胞壁中所含的肽聚糖外,最突出的是其胞壁中所含的內毒素。
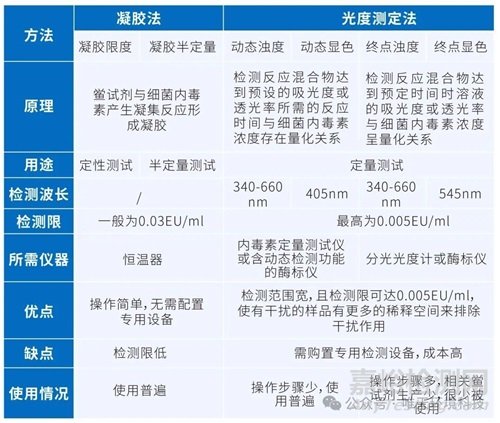
所以,內毒素是革蘭陰性菌的主要毒力因子。內毒素檢測方法一般有凝膠法和光度測定法。
1、檢測方式對比
凝膠法分為凝膠限度法和凝膠半定量法;光度測定法又分為濁度法和顯色基質法,其中濁度法分為動態濁度法和終點濁度法,顯色基質法分為動態顯色法和終點顯色法。
不同檢測方法的比較,見下表:
2、凝膠法
凝膠法是利用鱟血液中的變性細胞, 經裂解液和機械方式促使細胞破裂而提取到的一種細胞溶解物, 能與極微量的細菌內毒素形成特異凝膠反應, 反應的速度和凝膠的堅固程度與內毒素濃度有關。
1.細菌內毒素凝膠法檢測所需主要設備
(1)電熱干燥箱。
(2)旋渦混合器。
(3)超凈工作臺。
(4)試管恒溫儀、恒溫水浴箱或恒溫培養箱。
(5)鱟試劑。是從鱟的血液中提取出的凍干試劑,可以與細菌內毒素發生凝集反應。
(6)細菌內毒素工作標準品。
(7)細菌內毒素檢查用水應符合《中國藥典》規定的滅菌注射用水標準,其內毒素含量小于0.015EU/mL(用于凝膠法)或0.005 EU/mL(用于光度測定法),且對內毒素試驗無干擾作用。
(8)實驗所用器皿:需經處理,去除可能存在的外源性內毒素。耐熱器皿常用干熱滅菌法(250℃,至少30分鐘)去除,若使用塑料器具,如加樣吸頭等應置30%雙氧水中浸泡4h,再用細菌內毒素檢查用水充分沖洗后置60℃烘干備用。也可以選擇標明無熱原的商業產品。
(9)試驗常用材料器具:剪刀、砂輪、廢品缸(收集碎玻璃)、無熱原試管(10 mm×75 mm)、匹配的試管架、封口膜、酒精棉球、時鐘、移液器及無熱原吸頭。
2.鱟試劑靈敏度復核試驗
當使用新批號的鱟試劑或試驗條件發生了任何可能影響檢驗結果的改變時,應進行鱟試劑靈敏度復核試驗。
目的為考察鱟試劑的靈敏度是否準確,同時也考查檢驗人員操作方法是否正確及試驗條件是否符合規定。
3.供試品干擾試驗
干擾實驗的目 的是確定供試品在多大的稀釋倍數或濃度下對內毒素和鱟試劑的反應不存在干擾作用, 為能否使用細菌內毒素檢查法提供依據。并且驗證當供試品的配方和工藝有變化, 鱟試劑來源改變或供試品陽性對照結果呈陰性時供試品是否存在干擾作用。由于干擾實驗檢驗的是在供試品存在的情況下內毒素與鱟試劑的反應是否正常, 與所使用鱟試劑的靈敏度無關, 因此在干擾實驗預實驗中原則上可使用任一靈敏度的鱟試劑。但建議使用較低靈敏度(如 0.5 或 0.25EU/ m1)的鱟試劑, 可盡量避免供試品所含的內毒素對干擾實驗造成的陽性影響。
(1)對未知或可疑的供試品初次進行細菌內毒素試驗之前應先進行干擾試驗,目的是檢驗供試品對細菌內毒素試驗是否有抑制或增強作用,以及其他影響細菌內毒素試驗準確性和敏感性的干擾作用。
(2)當鱟試劑、供試品來源、供試品配方或生產工藝有變化或其他任何可能影響細菌內毒素試驗結果的試驗條件改變時,應重新進行干擾試驗。
(3)每種產品應取3批,并分別使用不少于兩個制造商生產的鱟試劑進行干擾試驗。
4.試驗準備
(1)確認所需試驗的試劑:鱟試劑、細菌內毒素工作標準品、細菌內毒素檢查用水
(2)確認所需試驗的器具材料(如上)
5.試驗方法
(1)同一批號選取至少3各單位供試品;
(2)供試液的制備:供試品應使用細菌內毒素檢查用水為浸提介質。根據本單位產品標準規定的細菌內毒素限值確定浸提介質的體積。
6.凝膠法操作方法
(1)細菌內毒素標準溶液的制備(按說明書進行)
(2)鱟試劑靈敏度復核試驗
根據鱟試劑靈敏度的標示值(λ),將細菌內毒素國家標準品或細菌內毒素工作標準品用細菌內毒素檢查用水溶解,在旋渦混合器上混勻15分鐘或參照標準品說明書中要求的混勻時間進行操作,然后制成2λ、λ、0.5λ和0.25λ四個濃度的內毒素標準溶液,每稀釋一步均應在旋渦混合器上混勻30秒或參照標準品說明書中要求的混勻時間進行操作。取不同濃度的內毒素標準溶液,分別與等體積(如0.1mL)的鱟試劑溶液混合,每一個內毒素濃度平行做4管;另外取2管加入等體積的細菌內毒素檢查用水作為陰性對照。將試管中溶液輕輕混勻后,封閉管口,垂直放入37℃±1℃的恒溫器中,保溫60分鐘±2分鐘。
圖片
將試管從恒溫器中輕輕取出,緩緩倒轉180°,若管內形成凝膠,并且凝膠不變形、不從管壁滑脫者為陽性;未形成凝膠或形成的凝膠不堅實、變形并從管壁滑脫者為陰性。保溫和拿取試管過程應避免受到振動,造成假陰性結果。
當最大濃度2λ管均為陽性,最低濃度0.25λ管均為陰性,陰性對照管為陰性,試驗方為有效。按下式計算反應終點濃度的幾何平均值,即為鱟試劑靈敏度的測定值(λc)。
λc=antilg(∑X/n)
式中 X 為反應終點濃度的對數值(lg)。反應終點濃度是指系列遞減的內毒素濃度中最后一個呈陽性結果的濃度;
n 為每個濃度的平行管數。
當λc在0.5~2λ(包括0.5λ和2λ)時,方可用于細菌內毒素檢查,并以標示靈敏度λ為該批鱟試劑的靈敏度。
(3)干擾試驗
a、應開展干擾試驗預實驗,確定供試品的最小不干擾稀釋倍數;采用多個不同稀釋倍數的供試品溶液,如某醫療器械產品限值為20EU/件,鱟試劑靈敏度為0.25EU/mL,按MVD=L/λ,【20EU/件÷0.25EU/mL=80】,則其最大有效稀釋倍數為80mL/件。
b、在預定的稀釋倍數下開展正式干擾試驗
按表1制備溶液A、B、C和D,使用的供試品溶液應為未檢驗出內毒素且不超過最大有效稀釋倍數(MVD)的溶液,按鱟試劑靈敏度復核試驗項下操作。
只有當溶液A和陰性對照溶液D的所有平行管都為陰性,并且系列溶液C的結果符合鱟試劑靈敏度復核試驗要求時,試驗方為有效。當系列溶液B的結果符合鱟試劑靈敏度復核試驗要求時,認為供試品在該濃度下無干擾作用。其他情況則認為供試品在該濃度下存在干擾作用。若供試品溶液在小于MVD的稀釋倍數下對試驗有干擾,應將供試品溶液進行不超過MVD的進一步稀釋,再重復干擾試驗。
可通過對供試品進行更大倍數的稀釋或通過其他適宜的方法(如過濾、中和、透析或加熱處理等)排除干擾。為確保所選擇的處理方法能有效地排除干擾且不會使內毒素失去活性,要使用預先添加了標準內毒素再經過處理的供試品溶液進行干擾試驗。
(4)凝膠限度試驗
按表2制備溶液A、B、C和D。使用稀釋倍數不超過MVD并且已經排除干擾的供試品溶液來制備溶液A和B。按鱟試劑靈敏度復核試驗項下操作。
(5)結果判斷
保溫60分鐘±2分鐘后觀察結果。
若陰性對照溶液D的平行管均為陰性,供試品陽性對照溶液B的平行管均為陽性,陽性對照溶液C的平行管均為陽性,試驗有效。
若溶液A的兩個平行管均為陰性,判定供試品符合規定。
若溶液A的兩個平行管均為陽性,判定供試品不符合規定。
若溶液A的兩個平行管中的一管為陽性,另一管為陰性,需進行復試。復試時溶液A需做4支平行管,若所有平行管均為陰性,判定供試品符合規定,否則判定供試品不符合規定。
若供試品的稀釋倍數小于MVD而溶液A結果出現不符合規定時,可將供試品稀釋至MVD重新實驗,再對結果進行判斷。
7.如供試品對細菌內毒素試驗有干擾,
可選用下列方法排除干擾:
(1)使用更靈敏的鱟試劑對供試液進行更大倍數稀釋;
(2)采用無熱原氨基甲烷緩沖液稀釋供試液;
(3)采用無熱原氫氧化鈉或鹽酸溶液調節供試液pH值在6.0~8.0范圍內;
(4)采用陽離子緩沖液稀釋供試液以調節離子濃度。
8.注意事項
(1)試驗操作應在清潔環境中進行,過程中應防止內毒素的污染。在使用移液器取樣時,應注意不要將移液器中的氣體吹入溶液中。
(2)試驗操作過程中人員應做好防護,避免割傷或內毒素標準品感染。
(3)開啟細菌內毒素國家標準品或工作標準品、鱟試劑時,先輕彈瓶壁,使粉末落入瓶底,然后用砂輪在瓶頸上部輕輕劃痕,藍點向外,75%酒精棉球擦拭后啟開,啟開過程中應防止玻璃碎片落入瓶內。
(4)溶解鱟試劑及混勻供試品和鱟試劑時,試驗過程中應注意更換吸頭,以避免檢查用水的污染及溶液的交叉污染。
(5)由于凝集反應是不可逆的,所以在反應過程中及觀察結果時應注意不要使試管受到振動,使凝膠破碎產生假陰性結果。
(6)進行干擾試驗時,標準對照系列和含內毒素的供試品溶液系列應同時進行;如經檢驗證實供試品對細菌內毒素試驗有不能排除的干擾作用則不適宜采用凝膠限度法。
(7)在進行鱟試劑靈敏度復核、干擾試驗和供試品細菌內毒素檢查時,各個試驗中要求的對照應同時進行,并在試驗有效的情況才能進行計算和判斷。
(8)2020版《中國藥典》1143細菌內毒素檢查法包括凝膠法和光度測定法。供試品檢測時,可使用其中任何一種方法進行試驗。當測定結果有爭議時,除另有規定外,以凝膠限度試驗結果為準。
3、光度法
光度檢測法包含濁度法和顯色法
1、濁度法
此方法是通過利用鱟試劑與內毒素反應發生濁度變化測定內毒素的含量。基于此試驗原理,可以分為終點濁度法和動態濁度法。終點濁度法是基于內毒素濃度與反應混合物在培養一段時間后的濁度(吸光度或透光率)的量化關系。動態濁度法是測定反應混合物達到預定吸光度或透光率需要的時間(初動時間)或濁度增加的速度的方法。進行此實驗時需要在鱟試劑生產商建議的培養溫度下進行(通常是37 ±1℃)。
2、顯色法
此方法是一種通過測定鱟試劑與內毒素反應產生的縮氨酸釋放出的顯色基團的來進行試驗的方法。基于以上特殊的試驗原理,此方法可以分為終點顯色法與動態顯色法。終點顯色法是基于內毒素的濃度與孵育結束時所釋放的顯色基團的量化關系的一種試驗方法。動態顯色法是測定反應混合物達到預定的吸收度所需要的時間或其顏色增長的速度。進行此實驗時需要在鱟試劑生產商建議的培養溫度下進行(通常是37±1℃)。
3、光度法標準曲線的可靠性試驗及供試品干擾實驗
為保證濁度和顯色試驗的有效性,應預先進行標準曲線的可靠性試驗以及供試品的干擾試驗。
4、標準曲線的可靠性試驗
對每一批次的鱟試劑均需要進行此項試驗。用標準內毒素溶液,需至少制備三個濃度的內毒素溶液,這些濃度需要在鱟試劑生產商所標示的靈敏度范圍內。根據鱟試劑的生產商的說明書(如:體積比,孵育時間,溫度,pH等),試驗時每一標準內毒素濃度至少做3個平行樣。
如果在動態試驗方法中,預期的范圍大于2個對數,應增加額外的標準,使得每個對數增加在標準曲線的范圍內。設定的內毒素的濃度范圍的相關系數,其絕對值|r|必須大于或等于0.980。
5、干擾實驗
按照表格配制溶液A、B、C、D,按使用的鱟試劑的相關說明對溶液A-D進行試驗,例如:關于供試品溶液及鱟試劑溶液的體積,供試品溶液與鱟試劑溶液的體積比,孵育時間等。
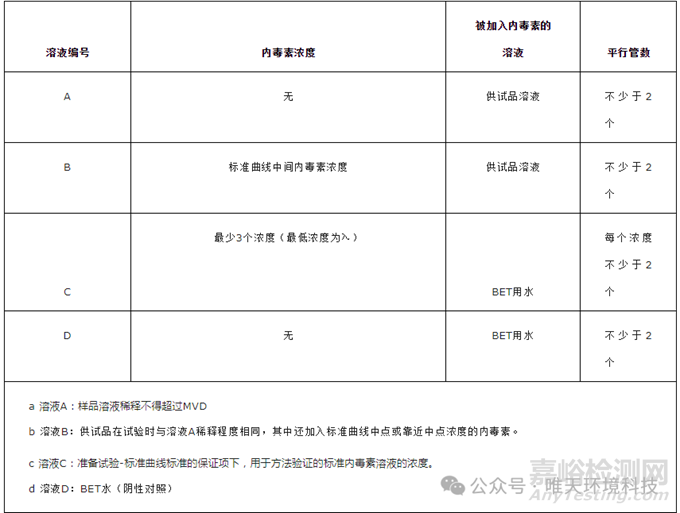
當試驗滿足以下條件時,該實驗被認為是有效的:
1. 用溶液C的建立的標準曲線的相關系數的絕對值大于或等于0.980。
2. 溶液D的試驗結果不超過所使用的鱟試劑的空白限度或小于所使用的鱟試劑的內毒素檢測限度。
3. 由溶液B 中檢測到的內毒素的濃度減去溶液A中檢測到的內毒素的濃度計算得到的內毒素回收率,其結果在50-200%的范圍內。
當內毒素的回收率超出規定的范圍,則認為供試品溶液存在干擾因素。用稀釋倍數更大(不超過MVD)的溶液重新試驗。此外,不超過MVD的供試品溶液或稀釋后供試品的溶液中存在的干擾可以通過適當的驗證過的處理方式來消除,列如過濾、中和、分離、加熱等方式。為了確認所采用的處理方式能有效的消除干擾且不會導致內毒素減少,用加入標準內毒素且已按照既定的處理方式處理后的供試品溶液按照上述規定進行試驗。

來源:唯天環境科技


